
物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
分析 (1)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;
②化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
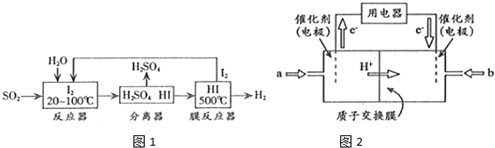
(2)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI;
②HI分解是可逆反应,分离出氢气有利于平衡正向移动;
(3)根据电子流向知,左边电极是负极、右边电极是正极,所以通入a气体的电极是负极、通入b的电极是正极,电解质溶液呈酸性,正极上氧气得电子和氢离子反应生成水.
解答 解:(1)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为:C+2NO?N2+CO2,
故答案为:C+2NO?N2+CO2;
②化学平衡常数K=$\frac{c({N}_{2}).c(C{O}_{2})}{{c}^{2}(NO)}$;
由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热、还是放热不确定,无法判断温度变化,故答案为:$\frac{c({N}_{2}).c(C{O}_{2})}{{c}^{2}(NO)}$;c;
(2)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI,反应方程式为SO2+I2+2H2O=SO42-+2I-+4H+,故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行,故答案为:HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
(3)根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向及电子流动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;O2+4e-+4H+=2H2O.
点评 本题考查氧化还原反应、原电池原理、化学平衡常数含义等知识点,为高频考点,明确物质性质、化学反应原理及原电池原理是解本题关键,难点是电极反应式的书写,注意结合电解质溶液酸碱性书写,题目难度不大.


科目:高中化学 来源: 题型:选择题
 已知电池的比能量是参与电极反应的单位质量的电极材料放出电能的大小.有关下述两种电池说法正确的是( )
已知电池的比能量是参与电极反应的单位质量的电极材料放出电能的大小.有关下述两种电池说法正确的是( )| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂硫电池充电时,锂电极发生还原反应 | |
| C. | 理论上两种电池的比能量相同 | |
| D. | 如图表示用锂离子电池给锂硫电池充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正极反应为Zn-2e-═Zn2+ | |
| B. | 电池总反应为Zn+Cu2+═Zn2++Cu | |
| C. | 取出盐桥,电流表指针仍然偏转 | |
| D. | 盐桥(填充KCl饱和溶液侵泡的琼脂)中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)CH3OH是一种可燃性的液体.
(1)CH3OH是一种可燃性的液体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
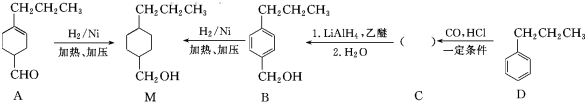
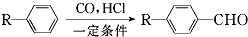
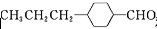 和
和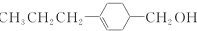 (写结构简式)生成.
(写结构简式)生成.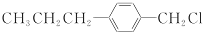 .
.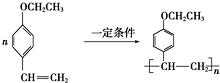 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
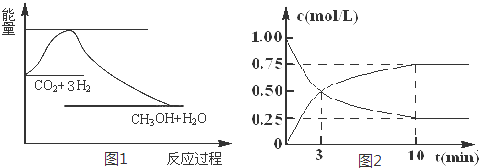
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
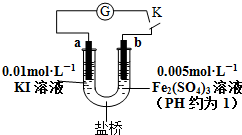
| A. | 电流计G指针指向零时,说明U形管中反应达到平衡状态 | |
| B. | 当电路中电流为零时,增加KI溶液的浓度,则a极为正极 | |
| C. | 当U形管b端颜色逐渐加深时,说明b极为负极 | |
| D. | 盐桥中阳离子一定向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
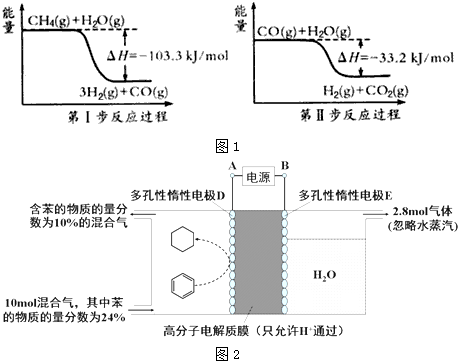
 $?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$
$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$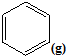 +3H2(g)
+3H2(g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com