
| A. | 向浓氨水中滴加饱和FeCl3溶液,可以制得Fe(OH)3胶体 | |
| B. | 为除去Mg(OH)2固体中少量Ca(OH)2,可用饱和MgCl2溶液多次洗涤后,再水洗、干燥 | |
| C. | 向溶液X中加入足量盐酸,产生无色无味气体,将气体通入澄清石灰水,产生白色沉淀,说明溶液X中含有CO32- | |
| D. | 卤代烃Y与NaOH醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀,说明卤代烃Y中含有氯原子 |
分析 A.浓氨水和饱和氯化铁溶液产生红褐色氢氧化铁沉淀;
B.氢氧化物表示方法相同时,溶度积产生大的物质能转化为溶度积常数小的物质;
C.碳酸根离子、碳酸氢根离子都能与稀盐酸反应生成无色无味且能使澄清石灰水变浑浊的气体;
D.卤代烃中卤元素的检验时,先将卤元素转化为卤离子,然后加入稀硝酸中和未反应的NaOH,最后用硝酸银检验卤离子.
解答 解:A.浓氨水和饱和氯化铁溶液产生红褐色氢氧化铁沉淀,氢氧化铁胶体的制备方法:在沸腾的蒸馏水中加入饱和氯化铁溶液加热,当溶液变为红褐色时应立即停止加热,故A错误;
B.氢氧化物表示方法相同时,溶度积产生大的物质能转化为溶度积常数小的物质,氢氧化镁溶度积常数小于氢氧化钙,所以可用饱和MgCl2溶液多次洗涤后可以除去氢氧化镁中的氢氧化钙,故B正确;
C.碳酸根离子、碳酸氢根离子都能与稀盐酸反应生成无色无味且能使澄清石灰水变浑浊的气体,所以原溶液中可能含有碳酸氢根离子,故C错误;
D.卤代烃中卤元素的检验时,先将卤元素转化为卤离子,然后加入稀硝酸中和未反应的NaOH,最后用硝酸银检验卤离子,则卤代烃Y与NaOH醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀,说明卤代烃Y中含有氯原子,故D正确;
故选BD.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、除杂、离子检验、元素检验等知识点,明确实验原理及物质性质是解本题关键,注意C中要排除其它离子的干扰,注意D在加硝酸银溶液之前必须加入稀硝酸,为易错点.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 室温下,1L pH=1的硫酸溶液中,含有H+的数目为0.1NA | |
| B. | 22.4L HCl和22.4L DCl中 所含质子数均为18NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 1 mol C3H6分子中碳碳共价键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

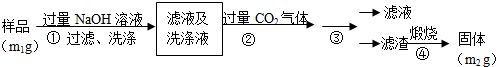
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
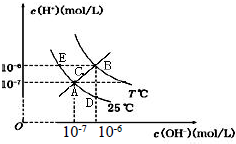
| A. | 图中五点Kw间的关系:B>C>A=D=E | |
| B. | E 点对应的水溶液中,可能有NH 4+、Ba 2+、Cl-、I-大量同时存在 | |
| C. | 若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有:c(HA-)>c(OH-)>c(A2- )>c(H2A) | |
| D. | 向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A 点所示,则溶液中反应:2H++SO4 2-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
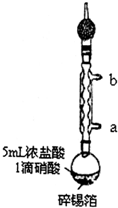 实验室制备无水二氯化锡的主要步骤如下:
实验室制备无水二氯化锡的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分散系的分类 | B. | 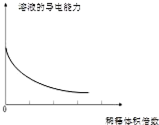 稀释浓氢氧化钠溶液的过程 | ||
| C. |  向碳酸钠溶液中逐滴滴加盐酸 | D. |  向偏铝酸钠溶液中逐滴滴加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的体积:V乙≤10V甲 | |
| B. | 若分别与5mlpH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 酸的种类 | 酸的浓度/mol•L-1 | 酸的体积/mL | 镁条质量/g |
| 1 | 醋酸 | 1.0 | 10 | 2.0 |
| 2 | 盐酸 | c | 10 | 2.0 |
| 编号 | 反应温度/℃ | Na2S2O3溶液/mL | 甲 | 0.10mol/L H2SO4溶液/mL | 乙 |
| 1 | 25℃ | 10.0 | 0 | 10.0 | |
| 2 | 25℃ | 5.0 | a | 10.0 | |
| 3 | 45℃ | 10.0 | 0 | 10.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com