
| A. | ①②⑤ | B. | ②④⑥ | C. | ②④ | D. | ③⑤⑥ |
分析 ①Cu2+为蓝色,
②pH=l1的溶液,显碱性;
③加入A1能放出H2的溶液,为非氧化性酸或强碱溶液;
④在由水电离出的c (OH-)=10-13mol•L-1的溶液,为酸或碱溶液;
⑤能使红色石蕊试纸变为蓝色的溶液,显碱性;
⑥强酸溶液中该组离子之间不反应.
解答 解:①Cu2+为蓝色,与无色不符,故不选;
②pH=l1的溶液,显碱性,该组离子之间不反应,可大量共存,故选;
③加入A1能放出H2的溶液,为非氧化性酸或强碱溶液,酸碱溶液均不能大量存在HCO3-,碱溶液中不能大量存在NH4+,酸溶液中NO3-、Al发生氧化还原反应不生成氢气,故不选;
④在由水电离出的c (OH-)=10-13mol•L-1的溶液,为酸或碱溶液,该组离子之间均不反应,可大量共存,故选;
⑤能使红色石蕊试纸变为蓝色的溶液,显碱性,S2-、ClO-发生氧化还原反应,不能共存,故不选;
⑥强酸溶液中该组离子之间不反应,可大量共存,故选;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中不一定含有SO42- |
| B | 光洁的铁钉放在冷的浓硫酸中,无明显现象 | 铁钉与冷的浓硫酸不反应 |
| C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色 | 氧化性:Br2>Fe3+>I2 |
| D | 向浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,产生的沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
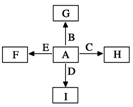 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物. ,它的空间构型是直线型分子;
,它的空间构型是直线型分子;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
在标准状况下,1体积水溶解672体积氨气,所得溶液密度为0.9g·cm-3,这种氨水的物质的量浓度和溶质的质量分数分别为( )
A.17.9mol·L-1 34.7% B.20.4mol·L-1 33.8%
C.17.9mol·L-1 33.8% D.20.4mol·L-1 34.7%
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、油脂、蛋白质都属于天然高分子形成的混合物 | |
| B. | 葡萄糖溶液中加入新制Cu(OH)2悬浊液煮沸会析出红色沉淀 | |
| C. | 氨基酸有两性,其脱水缩合得到的蛋白质就不再有两性 | |
| D. | 纤维素、淀粉都可用(C6H10O5)n表示,但它们并不为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com