
【题目】常温下氨气能被氯气氧化生成N2,化工厂常用此法检验管道是否泄漏氯气。某探究小组在实验室对氨气与氯气反应进行了探究,回答下列问题。
Ⅰ.氨气的制备
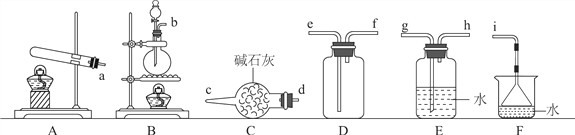
(1)氨气的发生装置可以选择上图中的________(填大写字母),反应的化学方程式为____________________________________。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,按气流方向写出其接口的连接顺序:发生装置管口→________(填小写字母)。
Ⅱ.氯气与氨气的反应
室温下,用收集到的氨气按下图所示装置进行实验(实验前k1、k2关闭)。
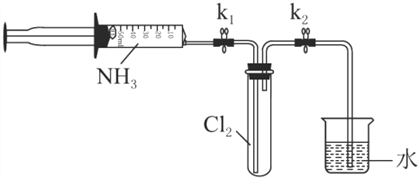
(3)打开k1,缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭k1,恢复室温。试管中可观察到的现象是________。发生反应的化学方程式为________。
(4)再打开k2,可观察到的现象是________。
【答案】 A 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O(或B NH3·H2O
CaCl2+2NH3↑+2H2O(或B NH3·H2O![]() NH3↑+H2O) d→c→f→e→(d→c→)i 生成白烟,而后凝结在试管内壁,试管内黄绿色气体颜色逐渐变浅至褪去 3C12+8NH3=6NH4Cl+N2(或分开写:3C12+2NH3=6HCl+N2、HCl+NH3=NH4Cl) 烧杯中的水倒流进入试管中
NH3↑+H2O) d→c→f→e→(d→c→)i 生成白烟,而后凝结在试管内壁,试管内黄绿色气体颜色逐渐变浅至褪去 3C12+8NH3=6NH4Cl+N2(或分开写:3C12+2NH3=6HCl+N2、HCl+NH3=NH4Cl) 烧杯中的水倒流进入试管中
【解析】Ⅰ.氨气的制备
(1)实验室通常用氯化铵与氢氧化钙加热法制备氨气,氨气的发生装置可以选择上图中的A,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。也可以选择B装置加热浓氨水制备少量氨气,反应的化学方程式为NH3·H2O
CaCl2+2NH3↑+2H2O。也可以选择B装置加热浓氨水制备少量氨气,反应的化学方程式为NH3·H2O![]() NH3↑+H2O。
NH3↑+H2O。
(2)实验室通常用盛有碱石灰的干燥管来干燥氨气,氨气会污染空气,所以要设计一个尾气处理装置,因为氨气极易溶于水,常用一个小漏斗倒扣在水面上吸收氨气。实验室常用向下排空气法收集氨气,为防止尾气吸收装置中的水蒸气回流进集气瓶,可以在两者之间再加一个盛有碱石灰的干燥管。所以欲收集一瓶干燥的氨气,选择上图中的装置,按气流方向写出其接口的连接顺序:发生装置管口→d→c→f→e→(d→c→)i。
Ⅱ.氯气与氨气的反应
根据题中信息“常温下氨气能被氯气氧化生成N2,化工厂常用此法检验管道是否泄漏氯气”可知,该反应中,氨气被氧化为氮气,氯气被还原为氯化氢,然后氯化氢再与氨气化合为氯化铵,反应的总化学方程式为3C12+8NH3=6NH4Cl+N2,所以若看到白烟产生,则证明有氯气从管道中泄漏。
(3)打开k1,缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭k1,恢复室温。试管中可观察到的现象是生成白烟,而后凝结在试管内壁,试管内黄绿色气体颜色逐渐变浅至褪去。发生反应的化学方程式为3C12+8NH3=6NH4Cl+N2(或分开写:3C12+2NH3=6HCl+N2、HCl+NH3=NH4Cl)。
(4)由化学方程式可知,向试管中注入约3倍于氯气体积的氨气,反应前3体积的氯气反应后变为1体积的氮气,还剩余约1体积的氨气,反应后试管中的气体变少了,试管中的气压小于外界大气压,所以打开k2,可观察到的现象是烧杯中的水倒流进入试管中。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料尼龙66具有良好的抗冲击性、韧性、耐燃油性和阻燃、绝缘等特点,因此广泛应用于汽车、电气等工业中。以下是生产尼龙66的一些途径。
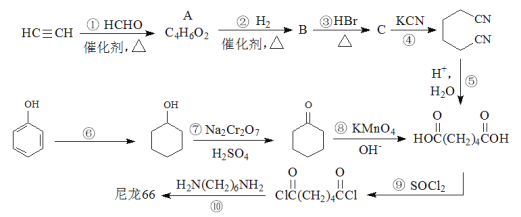
(1)A的结构简式为_____________。
(2)B中官能团的名称是_____________。
(3)反应①~④中,属于加成反应的有_______,反应⑥~⑨中,属于氧化反应的有_______。
(4)请写出反应⑥的化学方程式_____________。
(5)高分子材料尼龙66中含有![]() 结构片段,请写出反应⑩的化学方程式_____________。
结构片段,请写出反应⑩的化学方程式_____________。
(6)某聚合物K的单体与A互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为1:2:3,且能与NaHCO3溶液反应,则聚合物K的结构简式是_____________。
(7)聚乳酸(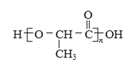 )是一种生物可降解材料,已知羰基化合物可发生下述
)是一种生物可降解材料,已知羰基化合物可发生下述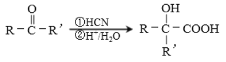 反应: (R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程。_______________
反应: (R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯橄岩为含镁的硅酸盐矿物,并含有MnO、Fe2O3、FeO、SiO2和一些有机物等杂质。工业上利用纯橄岩制备一水硫酸镁(MgSO4·H2O)的工艺流程如下:
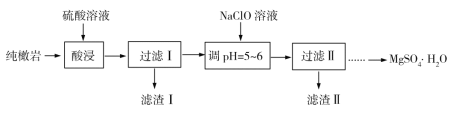
(1)浸出时温度控制在90℃~100℃之间,并且要连续搅拌2小时的目的是___________。
(2)上述流程中多次用到了过滤操作,实验室过滤时需要用到的玻璃仪器是玻璃棒、烧杯和________________。
(3)向过滤Ⅰ的滤液中加入NaClO溶液,将溶液中的Mn2+氧化成MnO2,反应的离子方程式为________________________________。
(4)滤渣Ⅱ中主要成分为________________(填化学式)。
(5)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验操作方法是________________________。
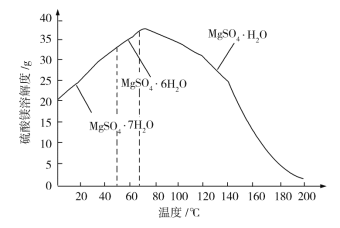
(6)已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从滤液中充分回收MgSO4·H2O,采取将滤液蒸发浓缩、加压升温结晶的方法,采取加压升温结晶的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种短周期元素①H、②C、③N、④O、⑤Na、⑥ Al、⑦Cl。
(1)①与③形成的简单氢化物的电子式是__________________,工业上利用该化合物制备NO的化学方程式_________________________________。
(2)⑤的单质在④的单质中燃烧,生成淡黄色固体。该产物中含有的化学键的类型是______________。
(3)②和⑦的气态氢化物中热稳定性较强的是__________(用化学式表示);能表示出②和⑦最高价氧化物水化物的酸性强弱的离子方程式是______________________________。
(4)①-⑦几种元素中,最高正价氧化物为两性的是__________(用化学式表示);写出它与氢氧化钠反应的化学方程式 __________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中央电视台报道联华超市在售的某品牌鸡蛋为“橡皮弹”,专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致。其结构简式如图:下列说法不正确的是( )
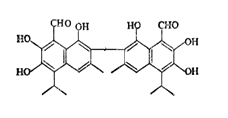
A. 该化合物的分子式为:C30H30O8
B. 1mol棉酚最多可与10mol H2加成,与6molNaOH反应
C. 在一定条件下,可与乙酸反应生成酯类物质
D. 该物质可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
已知:
颜色、状态 | 沸点(℃) | 密度(gcm﹣3) | |
苯甲酸* | 无色片状晶休 | 249 | 1.2659 |
苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
*苯甲酸在100℃会迅速升华.实验步骤如下:
①在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,控制温度在6570℃加热回流2h.反应时环己烷一乙醇﹣水会形成“共沸物”(沸点62.6℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒人盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如图所示),低温蒸出乙醚后,继续升温,接收210213℃的馏分.
⑤检验合格,测得产品体积为13.16mL.
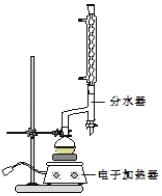
(1)在该实验中,圆底烧瓶的容积最适合的是_____(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中沸石的作用是____,使用分水器不断分离除去水的目的是_____.
(3)骤②中应控制馏分的温度在__.
A.215220℃ B.8590℃ C.7880℃ D.6570℃
(4)步骤③加入Na2CO3的作用是________;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是________.
(5)关于步骤④中的萃取分液操作叙述正确的是____.
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,CO2与1.0mol·L-1NaOH溶液充分反应放出的热量如下表:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | X |
2 | 1.0 | 2.00 | y |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学方程式为_____________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒温容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒温容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表:
温度 t/min | 0 | 40 | 80 | 120 | 160 |
甲(673K) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(T) | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙(673K) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
②该反应的△H__________(填序号)
a.大于0 b.小于0 c.等于0 d.不能确定
③丙容器达到平衡时,NO的转化率为__________________。
(3)298K时,NH3·H2O的电离常数Kb=2×10-5,H2CO3的电离常数Kal=4×10-7,Ka2=4×10-11。在NH4HCO3溶液中,c(NH4+)__________c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K的数值(用科学计数法表示)为_____。
NH3·H2O+H2CO3的平衡常数K的数值(用科学计数法表示)为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验法是学习化学的重要方法。
Ⅰ.海带中含有丰富的碘元素,以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2I-+Cl2=2Cl-+I2,碘与溴一样易溶于有机溶剂):
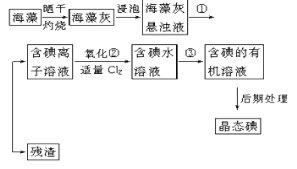
(1)实验操作①的名称:___。
(2)实验步骤②中加适量Cl2的目的__。
(3)实验步骤③提取碘的过程中,不能选用的溶剂是__。
A.苯 B.酒精 C.四氯化碳
(4)从海藻开始经过5步操作到含碘的有机溶液的实验过程中,要用到多种实验仪器。已知实验室里有坩埚、坩埚钳、烧杯、玻璃棒、酒精灯、石棉网、以及必要的夹持仪器等物品,尚缺少的玻璃仪器是___、___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com