
【题目】下表是元素周期表的一部分,请回答有关问题:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
(2)③元素与⑩元素两者核电荷数之差是
(3)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下列空格. 实验原理(化学方程式):
实验现象:
结论:
【答案】
(1)
(2)26
(3)Cl2+2NaBr=2NaCl+Br2;若加入氯水后溶液呈黄色,加入少量四氯化碳后,四氯化碳层呈棕色;证明单质氯比单质溴氧化性强
【解析】解:由元素在周期表中位置,可知①为C、②为N、③为F、④为Mg、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.(1)表中化学性质最不活泼的元素为Ar,原子核外有18个电子,各层电子数为2、8、8,原子结构示意图为:  , 所以答案是:
, 所以答案是:  ;(2)③元素是F、⑩元素是Br,为同主族元素,两者核电荷数之差为8+18=26,所以答案是:26;(3)元素⑦为氯,元素⑩为溴,氯单质将溴离子氧化为溴单质就能证明氯化溴的氧化性强.将氯水加入到溴化钠溶液中,振荡后,加入少量四氯化碳,振荡,四氯化碳层呈棕色,证明单质氯比单质溴氧化性强,所以答案是:Cl2+2NaBr=2NaCl+Br2;将少量氯水加入盛有溴化钠溶液的试管中,振荡后,加入少量四氯化碳,振荡;若加入氯水后溶液呈黄色,加入少量四氯化碳后,四氯化碳层呈棕色;证明单质氯比单质溴氧化性强.
;(2)③元素是F、⑩元素是Br,为同主族元素,两者核电荷数之差为8+18=26,所以答案是:26;(3)元素⑦为氯,元素⑩为溴,氯单质将溴离子氧化为溴单质就能证明氯化溴的氧化性强.将氯水加入到溴化钠溶液中,振荡后,加入少量四氯化碳,振荡,四氯化碳层呈棕色,证明单质氯比单质溴氧化性强,所以答案是:Cl2+2NaBr=2NaCl+Br2;将少量氯水加入盛有溴化钠溶液的试管中,振荡后,加入少量四氯化碳,振荡;若加入氯水后溶液呈黄色,加入少量四氯化碳后,四氯化碳层呈棕色;证明单质氯比单质溴氧化性强.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据下列实验或实验操作和现象,所得结论正确的是:
选项 | 实验或实验操作 | 现象 | 实验结论 |
A | 用大理石和盐酸反应产生的气体立即通入一定浓度的Na2SiO3 溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蒸发皿中将下列物质的溶液加热蒸干并灼烧,可以得到该物质固体的是( )
A. Al2(SO4)3 B. NaHCO3 C. KMnO4 D. FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境密切相关.近年来雾霾问题已成为百姓所关注的主要问题,今年入秋以来,我国大部分地区更是“霾伏”四起,部分地区持续出现中度至重度霾,环境治理刻不容缓.回答下列问题:
(1)下列有关说法正确的是
A.光化学烟雾是氮氧化物与碳氢化合物受紫外线作用后产生的有毒烟雾
B.PH小于7的雨水都是酸雨
C.PM2.5含量的增加是形成雾霾天气的重要原因之一
D.大气中CO2含量的增加会导致臭氧空洞的加剧
(2)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
①工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是:;(两个);不采用铜跟浓硫酸反应来制取硫酸铜的原因是(答两点)
②在一定体积的10molL﹣1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积(填“大于”、“等于”或“小于”)180mL.
③若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为
④将8g Fe2O3投入到150mL某浓度的稀硫酸中,再投入7g铁粉,充分反应后,收集到1.68L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4molL﹣1的NaOH溶液150mL.则原硫酸的物质的量浓度为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应,又属于吸热反应的是
A.锌片与稀硫酸的反应 B.灼热的碳与水蒸气的反应
C.甲烷在空气中的燃烧反应 D.Ba(OH)2·8H2O与NH4Cl的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,己知其燃烧热ΔH=-3677kJ/mol(P被氧化为P4O10),下列有关P4S3 的说法中不正确的是
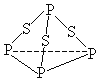
A. P4S3中磷元素为+3价
B. 分子中每个原子最外层均达到8电子稳定结构
C. 热化学方程式为P4S3(s)+8O2(g)=P4O10(s)+3SO2(g);△H=-3677kJ/mol
D. 分子中存在极性键与非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:
 它所对应的化学反应为:__________
它所对应的化学反应为:__________
(2)已知在400℃时,N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正_____v(N2)逆(填:>、<、=、不能确定);欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积分数增加,
2NH3(g) ΔH<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正_____v(N2)逆(填:>、<、=、不能确定);欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积分数增加,
可采取的正确措施是____________(填序号)
A. 缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:
A(g)+3B(g) ![]() 2C(g)+D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
2C(g)+D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
t/K | 300 | 400 | 500 | …… |
K/(mol·L-1)2 | 4×106 | 8×107 | K1 | …… |
请完成下列问题:
①判断该反应的ΔH _______0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是________ (填序号)。
A. 3v(B)(正)=2v(C)(逆) B.容器内压强保持不变
C.A和B的转化率相等 D.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于人体所需的基本营养物质的说法不正确的是
A. 在人体内,油脂的主要反应是在脂肪酶催化下水解为高级脂肪酸和甘油
B. 加酶洗衣粉中的酶其实是蛋白质
C. 糖类、油脂、蛋白质都能在一定条件下发生水解反应
D. 糖类都由C、H、O三种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量转化的认识不正确的是
A.植物的光合作用使太阳能转化为化学能
B.人类使用照明设备主要是将电能转化为光能
C. 燃料燃烧时只是将化学能转化为热能
D. 生物体内的化学变化过程在能量上比在体外发生的一些能量转化更合理、有效
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com