
【题目】如图所示电池是一种新型储氢材料—镍电池(MHn—Ni),(MHn中金属和氢都为 0 价)。下列有关说法不正确的是
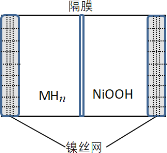
A.放电时正极反应为 NiOOH+H2O+e-→Ni(OH)2+OH-
B.电池的电解液可为KOH 溶液
C.充电时阴极反应为 MHn+nOH--e-→nH2O+M
D.MHn 是一类储氢材料,n 越大,电池的比能量越高
【答案】C
【解析】
根据图示,镍电池(MHn—Ni)中应该选碱性溶液作电解质溶液,放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,负极:MHn+nOH--ne-=M+nH2O,总反应:MHn+nNiOOH=M+nNi(OH)2 ,充电时,阳极反应:Ni(OH)2+OH--e-=NiOOH+H2O,阴极反应:M+nH2O+ne-=MHn+nOH-,总反应:M+nNi(OH)2=MHn+nNiOOH;据此分析解答。
A.放电时,正极发生还原反应:NiOOH+H2O+e-=Ni(OH)2+OH-,故A正确;
B.为了防止MHn被氢离子氧化,镍电池中电解液应该为碱性溶液,可以用KOH作电解液,故B正确;
C.充电时,电池的负极作阴极,阴极发生还原反应:M+nH2O+ne-=MHn+nOH-,故C错误;
D.M为储氢合金,MHn为吸附了氢原子的储氢材料,其氢密度越大,电池的能量密度越高,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g)![]() xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指:
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指:
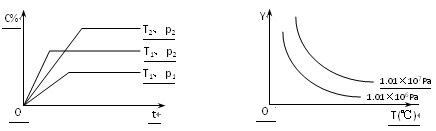
A.反应物A的物质的量 B.平衡混合气中物质B的质量分数
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是硫酸试剂瓶标签上的部分内容。据此下列说法中正确的是( )
硫酸 化学纯CP
500 mL
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
A.该硫酸可以用来干燥硫化氢气体
B.1molZn与足量的该硫酸反应能产生2gH2
C.配制250mL4.6mol·L-1的稀硫酸需取该硫酸62.5mL
D.若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气代替石油生产液体燃料和基础化学品是当前化学研究和发展的重点。
(1)我国科学家创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产乙烯、芳香烃Y和芳香烃Z等重要化工原料,实现了CO2的零排放,碳原子利用率达100%。已知Y、Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种。
①有关化学键键能数据如表中所示:
化学键 | H-H | C=C | C-C | C≡C | C-H |
E(kJ/mol) | 436 | 615 | 347.7 | 812 | 413.4 |
写出甲烷一步生成乙烯的热化学方程式:_____________;
②已知:原子利用率=期望产物总质量/反应物总质量×100%,则甲烷生成芳香烃Y的原子利用率为______;
③生成1 mol Z产生的H2约合标准状况下________L。
(2)如图为乙烯气相直接水合法制备乙醇过程中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
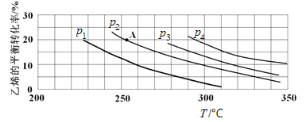
①若p2=8.0 MPa,列式计算A点的平衡常数Kp=_______(用平衡分压代替平衡浓度计算;分压=总压×物质的量分数;结果保留到小数点后两位);
②该反应为______(填“吸热”或“放热”)反应,图中压强(p1、p2、p3、p4)的大小关系为_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维尔纳配合物M是一种橙黄色单斜晶体,该晶体以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品中的氨全部蒸出,用500.00 mL 7.0 mol/L的盐酸溶液吸收,吸收结束后量取吸收液25.00 mL,用2.00 mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50 mL。
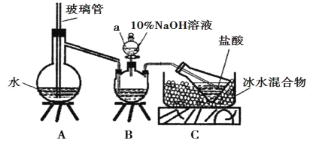
步骤二,氯的测定:准确称取橙黄色晶体w g,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)上述装置A中,玻璃管的作用是_________;
(2)装置A、B三脚架处应放置一个酒精灯作为热源,酒精灯应放置在_____(填“A”或“B”)处。
(3)步骤一所称取的样品中含氮的质量为______g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将______(填“偏高”“偏低”或“无影响”);冰水混合物的作用是_______________。
(5)测定氯的过程中,使用棕色滴定管的原因是________
(6)经上述实验测定,配合物M中钴、氮、氯的物质的量之比为1∶6∶3,其中氮元素以氨的形式存在。制备M的化学方程式为_____,其中双氧水的作用是____;制备M的过程中温度不能过高的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法错误的是( )
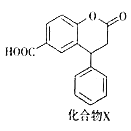
A. 在酸性条件下水解,水解产物只有一种
B. 能与饱和NaHCO3溶液反应产生CO2气体
C. 1mol化合物X最多能与3mol NaOH反应
D. 分子中两个苯环一定处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100.0 mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到16.84g沉淀,用过量稀硝酸处理后沉淀质量减少至6.99g,同时溶液中有气泡产生。试求:
(1)原混合液中Na2SO4的物质的量浓度为_____;
(2)产生的气体在标准状况下的体积为多少__________?(要求写出计算过程,只写结果不给分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用于解释事实的离子方程式不正确的是( )
A.向AgCl悬浊液中加入Na2S溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)
Ag2S(s)+2Cl-(aq)
B.向酸性KMnO4溶液中加入NaHSO3固体,溶液紫色褪去:2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O
C.向NaHCO3溶液中加入过量澄清石灰水,有白色沉淀生成:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com