
【题目】苹果酸的结构简式为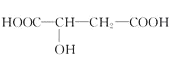 苹果酸可能发生的反应是( )
苹果酸可能发生的反应是( )
①与NaOH溶液反应;②与石蕊试液作用变红;③与金属钠反应放出气体;
④一定条件下与乙酸酯化;⑤一定条件下与乙醇酯化:
A.①②③B.①②③④C.①②③⑤D.①②③④⑤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素。
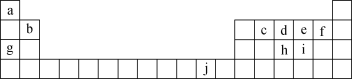
回答下列问题:
(1)写出元素f的基态原子核外电子排布式:__。
(2)写出元素h的基态原子核外电子轨道表示式:__。
(3)ci2分子的电子式为__。
(4)第一电离能:h__(填“>”“<”或“=”,下同)i;电负性:g__b。
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的叙述正确的是__(填字母)。
A.j位于元素周期表中第4周期ⅠB族,属于ds区元素
B.d的基态原子中,2p轨道为半充满,属于p区元素
C.最外层电子排布式为4s1,该元素一定属于第ⅠA族
D.最外层电子排布式为ns2np1,该元素可能是第ⅢA族或ⅢB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的c(H+)=0.1 mol·L-1。下列叙述不正确的是( )
A. 反应中共消耗1.8 mol H2SO4B. 气体甲中SO2与H2的体积比为4∶1
C. 反应中共消耗97.5 g ZnD. 反应中共转移3 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氨基甲酸铵置于密闭容器中,一定条件下发生反应: H2NCOONH4(s) ![]() CO2(g) + 2NH3(g) 。下列不能作为平衡状态判定依据的是
CO2(g) + 2NH3(g) 。下列不能作为平衡状态判定依据的是
A.混合气体的密度保持不变
B.混合气体的平均摩尔质量保持不变
C.二氧化碳浓度保持不变
D.混合气体的压强保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O反应速率的影响因素,有关实验数据如下表所示:
实验 编号 | 温度 (℃) | 催化剂用量(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4 溶液褪色平均时间(min) | ||
体积 (mL) | 浓度 (mol·L-1) | 体积 (mL) | 浓度 (mol·L-1) | ||||
1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
下列说法不正确的是
A.反应速率:v(实验3) > v(实验1)
B.a<12.7,b>6.7
C.用H2C2O4表示实验1的反应速率:v(H2C2O4)≈6.6×l0-3mol·L-1·min-1
D.相同条件下可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如图所示.下列叙述正确的是( )
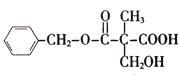
A.A不能和新制Cu(OH)2悬浊液反应
B.A中含有2种含氧官能团
C.A能够发生加成、取代和消去反应
D.1molA和足量的NaOH溶液反应,消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:
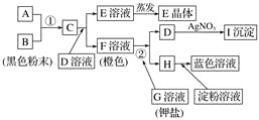
(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要准确掌握化学基本概念和研究方法。按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
第二组 | NaOH | HCl | NaCl | Na2O | CO |
第三组 | NaOH | CH3COOH | CaSO4 | H2O2 | SO2 |
每组分类均有错误,其错误的物质分别是________、________、________(填化学式)。
(2)胶体和溶液的本质区别是______________;鉴别胶体和溶液所采用的方法是观察是否能发生______________效应。
(3)下列3个反应,按要求填写相关量。
①2Na2O2+2H2O![]() 4NaOH+O2↑反应中,每生成1分子 O2转移________个电子;
4NaOH+O2↑反应中,每生成1分子 O2转移________个电子;
②2NaHCO3![]() Na2CO3+H2O+CO2↑反应中,每消耗168 gNaHCO3,生成________g CO2;
Na2CO3+H2O+CO2↑反应中,每消耗168 gNaHCO3,生成________g CO2;
③Cl2+H2O![]() HCl+HClO反应中,每消耗10分子 Cl2,转移________个电子。
HCl+HClO反应中,每消耗10分子 Cl2,转移________个电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,对含有氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O①
2NO2+2NaOH===NaNO2+NaNO3+H2O②
在反应①中,氧化剂是________________,还原剂是________________,在反应②中,氧化剂和还原剂的物质的量之比为___________________________________________。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成N2和CO2,该反应的化学方程式为____________________________。
(3)由反应②判断二氧化氮是否为酸性氧化物(填“是”或“不是”)________,原因是________________________________________________________________________。
(4)目前有一种治理方法是在一定条件下,用氨气将氮氧化物转化为无污染的物质,请写出该反应的化学方程式:________________________________________________,该反应中,氧化剂是________,氧化产物是________,生成1.4 mol氮气时,转移电子的物质的量为_______________________________________________。
(5)为了保护环境,工业上常通入NH3使氮的氧化物和氨转化为无毒的N2。现有NO2和NO的混合气体3 L,通入3 L(同温同压下)NH3,恰好使其完全转化为N2,则原混合气体中NO2和NO的物质的量之比为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com