
��NAΪ����٤��������ֵ������˵����ȷ����
A������£�11.2L SO3�����ķ�����ĿΪ0.5 NA
B�������£�1L pH=1��ϡ������Һ�У���ˮ�����H+������ĿΪ0.2NA
C��Ǧ���طŵ�ʱ����������4mol H+�����·��ͨ���ĵ�����ĿΪ2NA
D��8 Al + 3NH4ClO4 =4 Al2O3 +3NH3 +3HCl ��Ӧ�У�����27gAl��ʱ��ת�Ƶĵ�����ĿΪ2.75NA��Alԭ������27��
C
��������
���������A������£� SO3�ǹ��壬����ʹ������Ħ�����������B�������£�1L pH=1��ϡ������Һ�У�c(OH-)=10-13mol/L,����1L����Һ��ˮ�����H+������ĿΪ10-13NA������C��Ǧ���طŵ�ʱ�������Ϸ����ķ�Ӧ�ǣ�PbO2+2e-+4H+=Pb2++2H2O������������4mol H+�����·��ͨ���ĵ�����ĿΪ2NA����ȷ��D��8 Al + 3NH4ClO4 =4 Al2O3 +3NH3 +3HCl ��Ӧ�У�����27gAl��ʱ��ת�Ƶĵ�����ĿΪ3NA������
���㣺���鰢��٤�������ļ����֪ʶ��


 ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��С�մ�����ᷴӦ������������θ������ҩ�� | B���Ȼ����ǵ���ʣ��ɵ����ˮ��Һ��ý����� | C��SO2����Ư���ԣ������ڽ�����Ư��Ϊ��ѩ���� | D������������е����ԣ��������������ά |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и�����ѧ�ڵ�һ�νο��������Ծ��������棩 ���ͣ������
��16�֣������أ�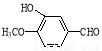 ����ʳƷ���Ӽ�������ԭ�ϣ���ϳ�·�����£�
����ʳƷ���Ӽ�������ԭ�ϣ���ϳ�·�����£�
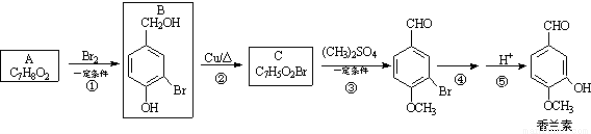
��1��д��A�Ľṹ��ʽ ��1 mol A��ȫ��Ӧ����O2�����ʵ���Ϊ mol��
��2��д����Ӧ�ڵĻ�ѧ����ʽ_______________________________��
��3����Ӧ�۵ķ�Ӧ������_____��1 mol��������һ����������H2������Ӧ���������H2_________mol��
��4��D�������ػ�Ϊͬ���칹�壬����NaHCO3��Һ��Ӧ�ų����壬��FeCl3��Һ����ɫ���ұ����ϵ�һ��ȡ����ֻ��2�֣���д��D�Ľṹ��ʽ______��
��5�������ص���һ��ͬ���칹��ṹ��ʽΪ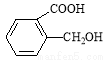 ����һ�������¿��Ժϳɾ����߷��ӣ�д���þ����߷��ӵĽṹ��ʽ_________��
����һ�������¿��Ժϳɾ����߷��ӣ�д���þ����߷��ӵĽṹ��ʽ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и����ڶ��ε��п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���г�������ȷ���������ϵ����
ѡ�� | ������ | ������ |
A | ������������ | ���������ڵ�̲��� |
B | SO2�������� | SO2������Ư��ֽ�� |
C | NH3��������ˮ | NH3����������� |
D | ClO2����ǿ������ | ClO2����������ˮ��ɱ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и���9�µڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��15�֣�������G�ĺϳ�·�����£�
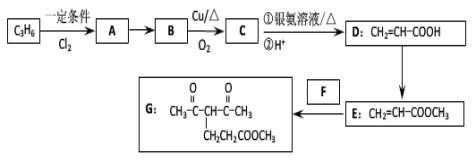
��1��D�к��������ŵ�����Ϊ ��1 molG�����ӳɷ�Ӧ������� mol H2 ��
��2��ȥ��E�к�������D���Լ��Ͳ����� �������й�E��˵����ȷ���� ������ĸ��ţ���
A���ɷ���������ӦB���������¿ɷ������۷�Ӧ
C���ɷ���ȡ����ӦD����CH2=CHCOOCH2CH3��ͬϵ��
E��������ˮ
��3��д��A��B�Ļ�ѧ��Ӧ����ʽ��
��4����ӦE + F��G����������˶��ӳɷ�Ӧ���ͣ���F�Ľṹ��ʽΪ ��
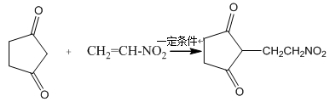
��5����G��2����ԭ�ӵ����ʾ����������ʣ���дһ�ָ����ʵĽṹ��ʽ ��
����FeCl3��Һ����ɫ�� �ڱ����ϵ�һ��ȡ����ֻ��һ�֣�
��1mol������������2mol Na��1mol NaOH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и�����ѧ�����п������ۻ�ѧ�Ծ��������棩 ���ͣ������
��16�֣�����֪���з�Ӧ���Ȼ�ѧ����ʽΪ��
C(s) + O2(g) CO2(g) ��H1 = -393.5 kJ/mol
CO2(g) ��H1 = -393.5 kJ/mol
CH3COOH(l) + 2O2(g) 2CO2(g) + 2H2O(l) ��H 2 = -870.3 kJ/mol
2CO2(g) + 2H2O(l) ��H 2 = -870.3 kJ/mol
2H2(g) + O2(g) 2H2O(l) ��H 3 = -571.6 kJ/mol
2H2O(l) ��H 3 = -571.6 kJ/mol
�����2C(s) + 2H2(g) + O2(g) CH3COOH(l) ��H 4 = ��
CH3COOH(l) ��H 4 = ��
����ij�¶��£�����(t��BuNO)2���������CCl4�ܼ��о����Է�����Ӧ��
(t��BuNO)2 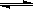 2(t��BuNO)
2(t��BuNO)
���¶��¸÷�Ӧ��CCl4�ܼ��е�ƽ�ⳣ��Ϊ1.4 mol/L��
��1����1 L�������м���0.50 mol (t-BuNO)2��10 minʱ��Ӧ��ƽ�⣬��ʱ(t-BuNO)2��ƽ��ת����Ϊ60%�����跴Ӧ��������Һ���ʼ��Ϊ1 L������Ӧ��ǰ10 min�ڵ�ƽ������Ϊv(t-BuNO)= ������������Ӧ��ƽ�ⳣ��K��(д��������̣�����������3λ��Ч����)
��2���йط�Ӧ��(t��BuNO)2 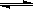 2(t��BuNO) ��������ȷ����________
2(t��BuNO) ��������ȷ����________
A��ѹǿԽ��Ӧ���ת����Խ�� B���¶����ߣ���ƽ��һ�������ƶ�
C���ܼ���ͬ��ƽ�ⳣ��Kֵ��ͬ
��3��ͨ����ɫ�����õ�40��ʱ(t��BuNO)2��(t��BuNO)Ũ����ʱ��ı仯��ϵ�ļ����������±���ʾ������ͬһͼ�л��(t��BuNO)2�ͣ�t��BuNO��Ũ����ʱ��ı仯���ߡ�
ʱ�䣨min�� | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
c(t��BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
c(t��BuNO) mol/L | 0 | 0.04 | 0.08 | 0.09 | 0.094 | 0.096 | 0.096 |

�״�ȼ�ϵ�صĵ������Һ��KOH��Һ����ͨ��״��ĵ缫��ӦʽΪ ����ͨ�����ĵ缫����32g O2�μӷ�Ӧ����Ӧ������ת����______ mol e����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и�����ѧ�����п������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����������и�����������Һ�У�һ���ܴ����������������
A����ʹpH��ֽ�ʺ�ɫ����Һ��Na����NH4+��I����NO3��
B��������������H2����Һ��K����Mg2����SO42����HCO3��
C��c(Fe3��)��0.1 mol��L��1����Һ��H����Al3����Cl����SCN��
D��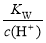 ��0.1 mol��L��1����Һ��Na����K����SiO32����NO3��
��0.1 mol��L��1����Һ��Na����K����SiO32����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ��ɽ�и���10���¿���ѧ�Ծ��������棩 ���ͣ������
(16��)̼������������������Ҫ�ķǽ���Ԫ�ء�
��1��CH4(g)��O2(g)��ȼ������CO(g)��H2O(g)�ġ�H����ֱ�Ӳ�����ԭ����
��2����ҵ�Ϻϳɰ����ķ�ӦΪ��N2(g) + 3H2(g)  2NH3(g) ��H<0���ֽ�10 mol N2��26 mol H2�����ݻ��ɱ���ܱ������У�N2��ƽ��ת����(
2NH3(g) ��H<0���ֽ�10 mol N2��26 mol H2�����ݻ��ɱ���ܱ������У�N2��ƽ��ת����(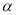 )����ϵ��ѹǿ(P)���¶�(T)�Ĺ�ϵ��ͼ��ʾ��
)����ϵ��ѹǿ(P)���¶�(T)�Ĺ�ϵ��ͼ��ʾ��
�ش��������⣺
�ٷ�Ӧ�ﵽƽ��״̬Bʱ���������ݻ�10 L����T1ʱ���ϳɰ���Ӧ��ƽ�ⳣ��K= ��
��ƽ��״̬��A�䵽Cʱ����Ӧ��ƽ�ⳣ��K(A) K(C)(�>������<����=��)��
��ƽ��״̬��A�䵽Bʱ����Ӧ��ƽ�ⳣ��K(A) K(B)(�>������<����=��)��
��3����25��ʱ��HSCN��HClO��H2CO3�ĵ��볣�����±���
HClO | HSCN | H2CO3 |
K=3.2��10-8 | K=0.13 | Kl=4.2��10-7 K2=5.6��10-11 |
��1 mol��L-1��KSCN��Һ�У��������ӵ�Ũ���ɴ�С��˳��Ϊ
����Na2CO3��Һ�м������HClO��Һ����Ӧ�Ļ�ѧ����ʽΪ
��ͬŨ�ȵ�A.NaClO B. Na2CO3 C. NaSCN �Ƚϸ���ҺpH�ɴ�С���� ����A.B.C�ش�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ��ɽ�и�����ѧ�ڵڶ���ģ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
��12�֣�����������Ҫ�ɷ���Al2O3����SiO2��Fe2O3��MgO�����ʣ�����ȡ�����������ֹ����������£�
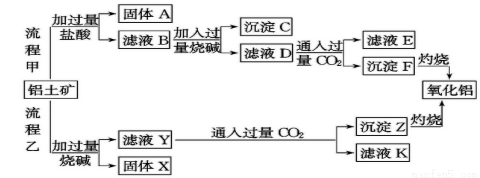
��ش��������⣺
��1�����̼������������Al3+�����ӷ���ʽΪ�� ��
��2�������Ҽ����ռ������SiO32-�����ӷ���ʽΪ______��
��3����֤��ҺB��Fe3+����ȡ������Һ������______�����Լ����ƣ���
��4����ҺE�����ʵ���Ҫ�ɷ���____(�ѧʽ)��д������Һ��һ����; ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com