
| A. | 2.7g A1与NaOH溶液完全反应,转移的电子数为0.2NA | |
| B. | 常温下,2.24L N2和O2的混合气体分子数为0.1NA | |
| C. | O.1 mol的14C中,含有的电子数为0.8NA | |
| D. | 0.1 mol H2(g)和0.3molCl2(g)于密闭容器中充分反应后,容器中气体分子总数为0.4NA |
分析 A.Al与NaOH溶液反应生成Na[Al(OH)4];
B.常温下,不能用气体摩尔体积22.4L/mol;
C.1mol14C中含有电子数为6mol;
D.H2(g)和Cl2(g)反应生成HCl(g).
解答 解:A.Al与NaOH溶液反应生成Na[Al(OH)4],Al从0价变为+3价,2.7gAl即0.1molAl参加反应,转移的电子数为0.3NA,故A错误;
B.常温下,不能用气体摩尔体积22.4L/mol,则2.24L N2和O2的混合气体分子数不为0.1NA,故B错误;
C.1mol14C中含有电子数为6mol,则0.1 mol的14C中,含有的电子数为0.6NA,个C错误;
D.H2(g)和Cl2(g)反应生成HCl(g),反应方程式为H2(g)+Cl2(g)═2HCl(g),0.1 mol H2(g)和0.3molCl2(g)于密闭容器中充分反应后,反应生成0.2molHCl(g),剩余0.2molCl2(g),则容器中气体分子总数为0.4NA,故D正确.
故选D.
点评 本题考查阿伏伽德罗常数的计算,明确一些常见的反应,注意气体摩尔体积22.4L/mol使用的条件是标准状况,题目难度不大.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑦ | B. | ③④⑤ | C. | ③⑤⑥ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20mL的某稀盐酸中滴入0.1mol•L-1的氨水,溶液中由水电离出的氢离子浓度随滴人氨水体积的变化如图.下列分析不正确的是( )
常温下,向20mL的某稀盐酸中滴入0.1mol•L-1的氨水,溶液中由水电离出的氢离子浓度随滴人氨水体积的变化如图.下列分析不正确的是( )| A. | V2=20 mL | B. | d点溶液中:c(NH4+)>c(Cl-) | ||
| C. | b点溶液中:c(H+)=c(OH-) | D. | 该稀盐酸的浓度为0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证 | |
| B. | 无法确定原溶液中是否存在Cl- | |
| C. | 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定 | |
| D. | 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
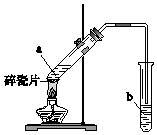 实验室用如图所示装置制备乙酸乙酯.
实验室用如图所示装置制备乙酸乙酯. 查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/(kJ/mol) | 890.3 | 1299.6 | 285.8 |
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | |
| B. | CH4和C2H2中所含化学键完全相同 | |
| C. | 2CH4(g)═C2H2(g)+3H2(g)△H=-376.4kJ/mol | |
| D. | C≡C键能为796.0kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中一定含有共价键,离子晶体中可能含有共价键 | |
| B. | 原子或离子之间强烈的相互吸引作用叫做化学键 | |
| C. | 金刚石、石墨、足球烯互为同素异形体,但晶体类型不同 | |
| D. | HCl溶于水能电离出氢离子和氯离子,故HCl是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题




| A. | ①③⑥ | B. | ②③⑤ | C. | 全部 | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com