
| A. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| B. | 丙烯的比例模型为: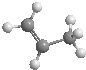 | |
| C. | 1mol物质: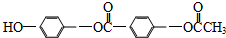 最多能与3mol NaOH反应 最多能与3mol NaOH反应 | |
| D. | CH3CN的电子式为: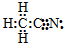 |
分析 A、分子式为CH4O和C2H6O的可以是醇或是醚;
B、比例模型主要体现出分子中各原子相对体积大小,B为球棍模型;
C、酚羟基、酯键可以与氢氧化钠反应,注意酯键水解后的酚羟基消耗氢氧化钠;
D、电子式表示原子最外层电子.
解答 解:A、分子式为CH4O和C2H6O的可以是醇或是醚,故A错误;
B、比例模型主要体现出分子中各原子相对体积大小,B为球棍模型,故B错误;
C、酚羟基、酯键可以与氢氧化钠反应,注意酯键水解后的酚羟基消耗氢氧化钠,1mol物质: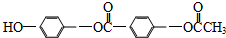 最多能与5mol NaOH,故C错误;
最多能与5mol NaOH,故C错误;
D、电子式表示原子最外层电子,CH3CN的电子式为: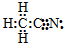 ,故D正确.
,故D正确.
故选D.
点评 本题考查常用化学用语的表示方法判断,题目难度中等,涉及球棍模型、结构简式、结构式等知识,注意掌握结构简式、结构式的区别,明确常见化学用语的书写原则为解答关键.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
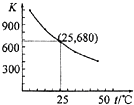 已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如图所示,下列说法正确的是( )
已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如图所示,下列说法正确的是( )| A. | 反应I2(aq)+I-(aq)?I3-(aq)的△H>0 | |
| B. | 利用该反应可以除去硫粉中少量的碘单质 | |
| C. | 在上述平衡体系中加入苯,平衡不移动 | |
| D. | 25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| B | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有白色固体析出 | 蛋白质均发生变性 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不再有白色沉淀产生,再滴加0.1mol•L-1FeCl3溶液,白色沉淀变为红褐色沉淀 | 在水中的溶解度 Mg(OH)2<Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中植物通过光合作用将太阳能转化为生物质能,而农村沼气池的建造、农作物制乙醇,都是有效的利用生物质能 | |
| B. | 纳米TiO2光触媒技术制成的“木地板精油”能将水气转化为活性氧,可以有效降解甲醛、苯、氨等居室污染物 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸、强碱都会“断路” | |
| D. | 同位素在医学显像、诊断和治疗,以及在改进农产品质量、增加产量等技术方面应用广泛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的氢化物的水溶液能与W的钠盐溶液,反应得到W的氢化物,说明非金属性M>W | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| C. | Y与Z形成的化合物能与碱反应,但不能和任何酸反应 | |
| D. | X和Y,W和M均能形成原子个数比为1:1的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 | |
| B. | 氢化锂也是一种储氢材料,供氢原理为LiH+H2O═LiOH+H2↑ | |
| C. | 生成等质量的氢气,反应①、②转移电子数之比为4:3 | |
| D. | LiAlH4是共价化合物,LiH是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的硫原子:${\;}_{16}^{34}$S | |
| B. | 氨分子的电子式: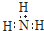 | |
| C. | 苯乙酸钠的结构简式: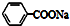 | |
| D. | H2SO3的电离方程式:H2SO3?2H++SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com