
【题目】根据信息书写相关反应方程式:
(1)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。回收废旧磷酸亚铁锂电池正极片[含Al、炭黑、LiFePO4(难溶于水和碱)]中各物质的流程如下图所示:

①写出“碱溶”时的离子方程式:________。
②写出“酸溶”时的化学方程式:________。
③LiFePO4可由Fe2O3、碳粉、LiH2PO4在480℃~900℃时混合共热制得,反应中还有CO生成,写出该反应的化学方程式:________。
(2)羟基自由基(电子式为![]() ,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
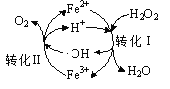
①pH=3时,Fe2+可循环催化H2O2的分解,过程中会产生·OH 中间体,转化过程如右图所示。写出转化Ⅱ的离子方程式:________。
②写出酸性条件下,·OH将水中的乙醛氧化成CO2和H2O的离子方程式:________。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ 6LiFePO4+12H2SO4+2HNO3=3Li2SO4+3Fe2(SO4)3+6H3PO4+2NO↑+4H2O Fe2O3+C+2LiH2PO4![]() 2LiFePO4+CO↑+2H2O 2Fe3++2·OH=2Fe2++O2↑+2H+ 10·OH+CH3CHO=2CO2↑+7H2O
2LiFePO4+CO↑+2H2O 2Fe3++2·OH=2Fe2++O2↑+2H+ 10·OH+CH3CHO=2CO2↑+7H2O
【解析】
(1)①废旧磷酸亚铁锂电池正极片中含Al,可溶解与强碱溶液;
②废旧磷酸亚铁锂电池正极片中含Al、炭黑和LiFePO4,其中Al在“碱溶”过程中完全溶解,因此在“酸溶”过程中溶解的是LiFePO4;
③根据氧化还原反应的规律书写方程式;
(2)①pH=3时,Fe3+氧化·OH生成Fe2+和O2,据此书写离子方程式;
②羟基自由基具有较强的氧化性,能将乙醛氧化为CO2和H2O。
(1)①废旧磷酸亚铁锂电池正极片中含Al,与氢氧化钠溶液反应生成偏铝酸钠和氢气,因此“碱溶”时的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
②“酸溶”过程中溶解的是LiFePO4,LiFePO4与H2SO4和HNO3反应生成Li2SO4、Fe2(SO4)3、H3PO4、NO和H2O,反应方程式为:6LiFePO4+12H2SO4+2HNO3=3Li2SO4+3Fe2(SO4)3+6H3PO4+2NO↑+4H2O;
③LiFePO4可由Fe2O3、碳粉、LiH2PO4在480℃~900℃时混合共热制得,反应中还有CO生成,方程式为:Fe2O3+C+2LiH2PO4![]() 2LiFePO4+CO↑+2H2O;
2LiFePO4+CO↑+2H2O;
(2)①pH=3时,Fe3+氧化·OH生成Fe2+和O2,离子方程式为:2Fe3++2·OH=2Fe2++O2↑+2H+;
②羟基自由基具有较强的氧化性,能将乙醛氧化为CO2和H2O,离子方程式为:10·OH+CH3CHO=2CO2↑+7H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
①室温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小
②在![]() =1012溶液中 Na+、I-、NO3-、SO42-不能大量共存
=1012溶液中 Na+、I-、NO3-、SO42-不能大量共存
③在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极
④锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
⑤高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
⑥用0.1 mol/LCH3COOH溶液滴定0.1 mol/LNaOH溶液至中性时:c(CH3COO-)+c(CH3COOH)>c(Na+)
⑦100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
⑧向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体
A.②④⑥B.①②⑦C.①④⑤D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______、______。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g,将样品装入石英玻璃管中,再次将装置A称重,记为m2g,按如图连接好装置进行实验。
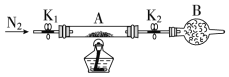
①仪器B的名称是______。
②将下列实验操作步骤正确排序______(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
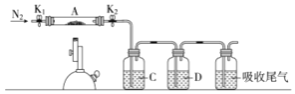
①C、D中的溶液依次为______(填标号)。C、D中有气泡冒出。
A.NaOH B.品红 C.浓H2SO4 D.Ba(NO3)2 E.BaCl2
②写出硫酸亚铁高温分解反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息,得出的结论不正确的是


A. 图1表示常温下向体积为10 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C. 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol-1
D. 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A.催化剂 a 表面发生了极性共价键的断裂和形成
B.N2 与 H2 反应生成 NH3 的原子利用率为 100%
C.催化剂 a、b 能提高反应的平衡转化率
D.在催化剂 b 表面 2.24 L NH3 反应生成 NO 转移电子数目为 0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究SO2的转化对环境保护具有重要意义。
(1)一种将SO2转化为H2SO4和S的反应为3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH
已知SO3(g)+H2O(g)=H2SO4(l) ΔH1=-177 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH2=-297 kJ·mol-1
2SO2(g)+O2(g)=2SO3(g) ΔH3=-197 kJ·mol-1 则ΔH=__________kJ·mol-1。
(2)SO2碱吸收液含NaHSO3和Na2SO3,NaHSO3可用于制取焦亚硫酸钠(Na2S2O5)。一种用SO2碱吸收液和三室膜电解技术制取NaHSO3的装置如图甲所示。已知常温下含硫微粒的物质的量分数如图乙所示,H2SO3的电离平衡常数K1=1.23×10-2、K2=5.6×10-8。

①电解后__________(填“a”、“b”或“c”)室的NaHSO3浓度较大。
②常温下,当SO2碱吸收液的pH=8时,溶液中c(SO32-)∶c(HSO3-)=__________。
③常温下0.1 mol·L-1 NaHSO3溶液中H2SO3、HSO3-、SO32-的物质的量浓度由大到小的顺序是__________。
(3)利用间接电化学法消除NO的原理如图丙所示。
①阴极的电极反应式为__________;
②吸收池每吸收转化1mol NO,阳极区生成标准状况下O2的体积为__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的说法正确的是
A. 铝箔在空气中受热可以熔化且会发生剧烈燃烧
B. ![]() 在空气中燃烧,发出黄色火焰,生成白色固体
在空气中燃烧,发出黄色火焰,生成白色固体
C. 铁与水蒸气反应的产物是黑色的![]()
D. 铝制餐具不宜用来盛装酸性、碱性较强的食物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算机芯片是一种用硅材料制成的薄片,其大小仅有手指甲的一半。一个芯片是由几百个微电路连接在一起的,体积很小,在芯片上布满了产生脉冲电流的微电路。计算机芯片利用这些微电流,就能够完成控制计算机、计算机自动化装置和其它各种设备所需要的操作。高纯硅是制备半导体材料的重要物质,工业上制备纯硅的方程式为:①![]() ②
②![]() ③
③![]() ;
;
![]() 的反应属于( )
的反应属于( )
A.置换反应B.化合反应C.分解反应D.复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述及解释正确的是
A.2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B.H2(g)+I2(g)![]() 2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C.对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡左移
2NH3,平衡后,压强不变,充入O2,平衡左移
D.FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com