
| A. | 绝对不溶解的物质是不存在的 | |
| B. | 不溶于水的物质其溶解度为零 | |
| C. | 某离子被沉淀完全,则该离子在溶液中的浓度为零 | |
| D. | 物质的溶解性为难溶,则该物质不溶于水 |
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:选择题
| A. | 定容时仰视容量瓶的刻度线 | |
| B. | 在用蒸馏水洗涤烧杯时,洗涤液未全部转移到容量瓶中 | |
| C. | 配制盐酸溶液用量筒量取浓盐酸时仰视刻度线 | |
| D. | 用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
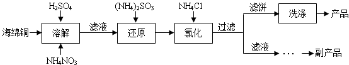
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素和非金属之间只存在离子键 | |
| B. | 共价化合物里,一定存在极性键 | |
| C. | 非金属元素之间只能形成共价键 | |
| D. | 在离子化合物不可能存在非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
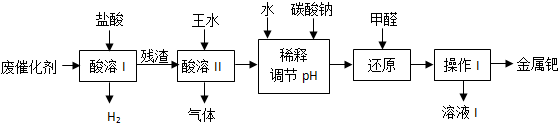
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 负极反应式:Ag+Cl-+e-═AgCl | |
| B. | Na+不断向“水”电池的正极移动 | |
| C. | 每生成1molNa2Mn5O10转移2mol电子 | |
| D. | AgCl是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质(杂质) | 所用试剂 | 分离方法 |
| A | 溴苯(Br2) | 苯 | 萃取、分液 |
| B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| C | CH4(C2H4) | 酸性高锰酸钾 | 洗气 |
| D | 硝基苯(硝酸) | 氢氧化钠溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
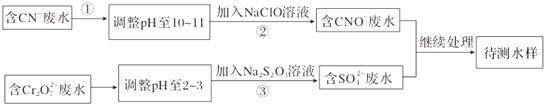
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


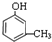
 ,
,
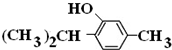 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$
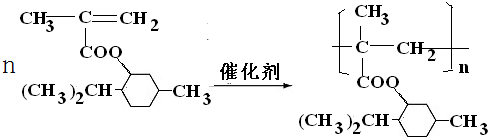 ;.
;.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com