
 S0
S0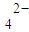 、N03-和N02-等.为确定其组成,分别进行下列4组实验,其中能确认样品中不含S0
、N03-和N02-等.为确定其组成,分别进行下列4组实验,其中能确认样品中不含S0 的实验操作是 (填下列实验操作序号);根据实验结果,你认为是否含有N02-?▲(填“含有”、“不含有”),其原因是 ;
的实验操作是 (填下列实验操作序号);根据实验结果,你认为是否含有N02-?▲(填“含有”、“不含有”),其原因是 ; 、Cl-四种离子,其中c(NH
、Cl-四种离子,其中c(NH )>c(Cl-)则这两种溶质的化学式分别是 .
)>c(Cl-)则这两种溶质的化学式分别是 .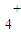 )>c(Cl-) 所以c(H+)<c(OH-)即溶液显碱性,故溶质为NH4Cl和NH3?H2O;
)>c(Cl-) 所以c(H+)<c(OH-)即溶液显碱性,故溶质为NH4Cl和NH3?H2O;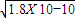 ,RY中c(R+)=
,RY中c(R+)=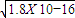 ,R2Z中c(R+)=
,R2Z中c(R+)=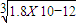 .
.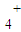 )>c(Cl-) 所以c(H+)<c(OH-)即溶液显碱性,所以溶质为NH4Cl和NH3?H2O,故答案为NH4Cl和NH3?H2O;
)>c(Cl-) 所以c(H+)<c(OH-)即溶液显碱性,所以溶质为NH4Cl和NH3?H2O,故答案为NH4Cl和NH3?H2O;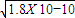 ,RY中c(R+)=
,RY中c(R+)=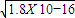 ,R2Z中c(R+)=
,R2Z中c(R+)=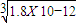 ,故答案为R2Z>RX>RY.
,故答案为R2Z>RX>RY.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸盐化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加溶液,加热,加入的氢氧化钠溶液体积(V)与生成的沉淀、产生的气体关系(n)如右图. |  |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO2)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(SO2)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
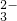 S0
S0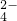 、N03-和N02-等.为确定其组成,分别进行下列4组实验,其中能确认样品中不含S0
、N03-和N02-等.为确定其组成,分别进行下列4组实验,其中能确认样品中不含S0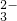 的实验操作是______(填下列实验操作序号);根据实验结果,你认为是否含有N02-?▲(填“含有”、“不含有”),其原因是______;
的实验操作是______(填下列实验操作序号);根据实验结果,你认为是否含有N02-?▲(填“含有”、“不含有”),其原因是______;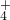 、Cl-四种离子,其中c(NH
、Cl-四种离子,其中c(NH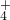 )>c(Cl-)则这两种溶质的化学式分别是______.
)>c(Cl-)则这两种溶质的化学式分别是______.查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:填空题
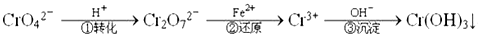
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O  Cr3+(aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_____。
Cr3+(aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_____。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com