
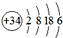 的元素,位于元素周期表的( )
的元素,位于元素周期表的( )| A. | 第六周期第Ⅳ族 | B. | 第四周期第Ⅵ族 | C. | 第六周期第ⅣA族 | D. | 第四周期第ⅥA族 |
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:解答题
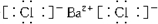 ,③的电子式是
,③的电子式是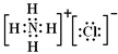 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
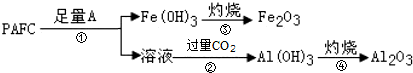
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | X、W分别与钠形成的化合物摩尔质量相同,且每种化合物中阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为离子化合物 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40 | B. | 41 | C. | 42 | D. | 48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂 | |
| B. | 丙三醇的沸点比乙二醇的沸点高,可用于配制化妆品 | |
| C. | 这两种多元醇都易溶于水,但难溶于有机溶剂 | |
| D. | 丙三醇可以制造炸药,乙二醇是制涤纶的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeI2的溶液中,通入足量Cl2:2Fe2++2I-+2Cl2═I2+2Fe3++4Cl- | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向水玻璃中通入过量的CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| D. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O═3I2+6OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com