
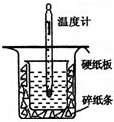
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题| 实验序号[来源:学#科#网] | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
| 3 | 25.1 | 25.1 | 25.1 | 27.1 | 2.0 |
| Q |
| n |
| 1.421kJ |
| 0.025mol |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与NaOH反应的氯气一定为0.3 mol |
| B、若反应中转移的电子为n mol,则0.15<n<0.25 |
| C、n(Na+):n(Cl-)可能为7:3 |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为8:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体、溶液、浊液都是分散系 |
| B、粒子的半径:浊液>溶液>胶体 |
| C、可见光通过溶液时,产生丁达尔现象 |
| D、胶体都不透明,且稳定性极强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LCH4所含质子数为0.1NA |
| B、0.1mol Fe与足量氯气反应转移的电子数为0.2NA |
| C、0.1mol C8H18分子中共价键总数为2.5NA |
| D、100mL 1mol/L醋酸溶液中离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
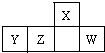 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A、原子半径:X>Y>Z>W |
| B、Y、Z是金属元素 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2溶液 |
| B、稀盐酸 |
| C、KOH溶液 |
| D、NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L (NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=4的醋酸稀释l0倍,溶液中c(CH3COOH)、c(OH-)均减小 |
| C、常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)=c(CH3COO-) |
| D、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com