
| A. | C2H5Br和NaOH溶液混合共热 | |
| B. | 乙醇和NaOH溶液混合共热 | |
| C. | 一溴丁烷与的NaOH的丁醇溶液混合共热 | |
| D. | 氯苯与NaOH溶液混合共热 |
分析 消去反应:在一定条件下,有机物脱去小分子生成含有不饱和键的有机物的反应;
卤代烃发生消去反应的条件:与卤原子所连碳原子相邻的碳原子有氢原子时,才可发生消去反应.
醇发生消去反应的条件:与羟基所连碳原子相邻的碳原子有氢原子时,才可发生消去反应
解答 解:A、C2H5Br和NaOH溶液混合共热生成乙醇和溴化钠,属于取代反应,故A错误;
B、乙醇和NaOH溶液混合共热不反应,但乙醇和浓硫酸混合共热生成乙烯,属于消去反应,故B错误;
C、一溴丁烷与KOH的丁醇溶液混合共热生成丁烯,属于消去反应,故C正确;
D、氯苯与NaOH溶液混合共热生成苯酚和氯化钠,属于取代反应,故D错误.
故选C
点评 本题主要考查醇、卤代烃的消去反应的特点与条件,难度不大,根据所学知识即可完成.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该醇是乙二醇 | B. | 该羧酸有3种同分异构体 | ||
| C. | 该羧酸的官能团含有羟基和羧基 | D. | 羧酸的分子式是C3H6O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1-氯丙烷中加NaOH溶液后加热:CH3CH2CH2Cl+NaOH$→_{△}^{水}$CH3CH=CH2↑+NaCl+H2O | |
| B. | 将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+ClO-═SO42-+Cl-+2H+ | |
| C. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3•H2O | |
| D. | 用过量的氨水吸收烟道气中的SO2:SO2+2NH3•H2O═2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
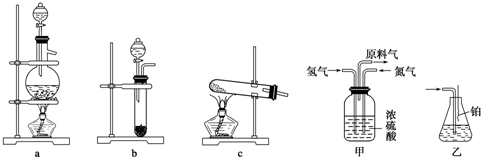
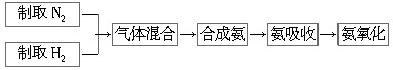
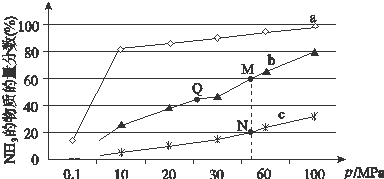
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都具有强氧化性 | |
| B. | 分别露置在空气中,容器内溶质的物质的量浓度都降低 | |
| C. | 常温下都可以储存于铝制槽罐中 | |
| D. | 和碳反应中都表现出强氧化性和强酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中存在6种微粒 | |
| B. | c(Na+)=c(HClO)+2c(ClO-) | |
| C. | c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| D. | 往所得中性溶液中加入NaHCO3能放出大量气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
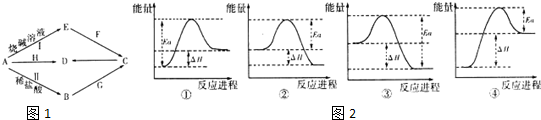
 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O.| 化学键 | O=O(g) | H-H(g) | H-O(g) |
| 键能/kJ•mol-1 | 496 | x | 463 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com