

 2NH3.
2NH3. 分析 Ⅰ.性质决定其用途,根据氨气性质写出其相应的用途,根据工农业生产选择其重要用途;
Ⅱ.①固态氯化铵加热分解成氨气和氯化氢,但氨气和氯化氢一冷却马上又可以化合成氯化铵;
②向固体氢氧化钠中滴加浓氨水,氢氧化钠吸水,放出大量热,促进NH3•H2O的分解及NH3的挥发逸出;
③氯化铵溶液与氢氧化钠溶液不易于收集氨气;
④固体氯化铵与氢氧化钙固体混合加热可以制取氨气;
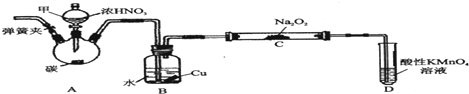
Ⅲ.实验步骤原理:①完成这一步后,相当于先在整个装置中通入了氢气,先把装置中的空气进行了排除,使氢气与氨气的反应更安全.②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示.氢气继续在瓶内燃烧,此时消耗的是无底细口瓶C中的氧气,几分钟后火焰因缺氧而熄灭;③步先点燃E处酒精灯,只是为了先给催化剂升温,因为催化剂也只有在适宜的温度下才能发挥最大的活性,对于铁触媒来说,温度应该为500℃,在这同时,继续通入氢气,待无底细口瓶C内水位下降到液面保持不变时,此时两种气体也混合的很均匀了,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,在这个地方氮气跟氢气进行反应生成氨气,但是这个反应是可逆反应,不可能大量的生成氨气,尽管氨气在水中的溶解度比较大,但由于该混合气体中氨气的量少,进入F装置的气体中,含有较多难溶性的气体,所以不易产生倒吸,据此回答.
(1)根据可燃性气体与空气混合后点燃可能发生爆炸进行分析解答;
(2)C瓶内水位下降到液面保持不变时,氮气和氢气混合均匀,A中试管内液面下降,长颈漏斗中液面上升,锌粒与酸脱离,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,氮气跟氢气进行反应,保证氢气含量较多,提高氮气的转化率,C中的气体成分是氮气和氢气;
(3)升高催化剂的温度,使催化剂达到最佳活性温度,以提高反应速率,氮气和氢气之间在催化剂的作用下发生反应生成氨气.
解答 解:I.氨气极易液化,气化时吸收热量,所以氨气能作制冷剂,氨气能和氧气反应生成一氧化氮、一氧化氮和氧气和水反应生成硝酸,硝酸为工业用三大强酸之一,利用氨气能生产化肥,所以氨气重要用途为制化肥、制硝酸,
故答案为:制硝酸、化肥;
II.①固态氯化铵加热分解成氨气和氯化氢,但氨气和氯化氢一冷却马上又可以化合成氯化铵,这个方案很难制氨气,故①错误;
②向固体氢氧化钠中滴加浓氨水,氢氧化钠吸水,放出大量热,促进NH3•H2O的分解及NH3的挥发逸出,故②正确;
③氯化铵溶液与氢氧化钠溶液共热反应太剧烈并且生成的氨气极易溶于水,不易收集氨气,故③错误;
④固体氯化铵与氢氧化钙固体混合加热可以制取氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,故④正确.
故选②④;
III.(1)氢气具有可燃性,加热不纯的氢气可能会发生爆炸,故检验氢气纯度的目的是排除空气,保证安全,
故答案为:排除空气,保证安全;
(2)当C瓶内水位下降到液面保持不变时,氮气和氢气两种气体也混合的很均匀了,C中的气体成分是氮气和氢气,A中试管内液面下降,长颈漏斗中液面上升,直到试管内液面和锌离分离,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,在这个地方氮气跟氢气进行反应生成氨气,并保证氢气含量较多,提高氮气的转化率;
故答案为:锌粒与酸脱离;尽量增大氢气的浓度以提高氮气的转化率;N2、H2;
(3)第③步先点燃E处酒精灯,只是为了先给催化剂升温,因为催化剂也只有在适宜的温度下才能发挥最大的活性,对于铁触媒来说,温度应该为500℃,所以用酒精灯加热反应管E-段时间后再打开弹簧夹b,是为了升高催化剂的温度,使催化剂达到最佳活性温度,以提高反应速率,氮气和氢气之间在催化剂的作用下发生反应生成氨气,即N2+3H2 2NH3,
2NH3,
故答案为:铁触媒在较高温度时活性增大,加快氨合成的反应速率;N2+3H2 2NH3.
2NH3.
点评 本题考查了氨气的制取、氨气的催化氧化的实验方案设计,考查学生分析和解决问题的能力,注意知识的归纳和梳理是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | t2时加入了催化剂 | B. | t3时降低了温度 | ||
| C. | t5时增大了压强 | D. | t4~t5时间内转化率最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水能被弱酸醋酸中和 | |
| B. | 铵盐受热易分解 | |
| C. | 氨水可以使酚酞试液变红 | |
| D. | 0.lmol/L氨水溶液,常温时pH约为11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 30% | C. | 50% | D. | 90% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “中和热的测定”实验步骤为:
“中和热的测定”实验步骤为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-、H2O、F- | B. | NH3、NH4+、F- | C. | H3O+、NH4+、Cl- | D. | HCl、F2、H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com