
己知:|||+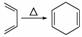 ,如果要合成
,如果要合成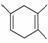 ,所用的起始原料可以是( )
,所用的起始原料可以是( )
①2甲基1,3丁二烯和2丁炔 ②1,3戊二烯和2丁炔 ③2,3二甲基1,3戊二烯和乙炔 ④2,3二甲基1,3丁二烯和丙炔
A.①④ B.②③
C.①③ D.②④
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
萤火虫会在夏日的夜空发出点点光亮,这是一种最高效的发光机制。萤火虫发光的原理是荧光素在荧光酶和ATP催化下发生氧化还原反应时伴随着化学能转变为光能:
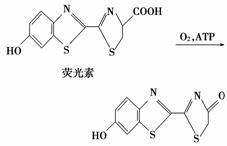
荧光素属于( )
A.无机物 B.烃
C.芳香族化合物 D.高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关烯烃的说法中,正确的是( )
A.烯烃分子中所有的原子一定在同一平面上
B.烯烃在适宜的条件下只能发生加成反应,不能发生取代反应
C.分子式是C4H8的烃分子中一定含有碳碳双键
D.烯烃既能使溴水褪色也能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应A(g)+B(g)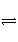
 C(g)+D(g),在四种不同情况下的反应速率如下,其中反应进行的最快的是( )
C(g)+D(g),在四种不同情况下的反应速率如下,其中反应进行的最快的是( )
A.v(A)=0.15 mol·L-1·min-1 B.v(B)=0.6 mol·L-1·min-1
C.v(C)=0.4 mol·L-1·min-1 D.v(D)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中[H+]的增大而加快。
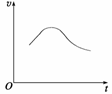
反应开始时反应速率加快的原因是
________________________________________________________________________
________________________________________________________________________
________________;
反应后期反应速率减慢的原因是
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(l)===2NH3(g)+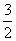 O2(g)
O2(g)
ΔH=765.2 kJ·mol-1
回答下列问题:
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议:
________________________________________________________________________
________________________________________________________________________。
(3)工业合成氨的反应为N2(g)+3H2(g)
 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为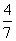 。计算:
。计算:
①该条件下N2的平衡转化率;
②该条件下反应2NH3(g)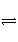
 N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
硒(Se)是人体必需的微量元素,在元素周期表中的位置如下图。下列关于硒元素的叙述正确的是
A. 硒位于元素周期表第四周期第IVA族
B. 硒的非金属性比S弱
C. H2Se比HBr稳定
D. 最高价氧化物的化学式为SeO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com