
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯铜作阳极,含Zn、Ag的Cu合金作阴极 | |
| B. | 含Zn、Ag的Cu合金作阳极,纯铜作阴极 | |
| C. | 用纯铁作阳极,纯铜作阴极 | |
| D. | 用石墨作阳极,用惰性电极(Pt)作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1949年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图所示:呈V型,键角116.5°.三个O原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)-三个O原子均等地享有这4个电子.请回答:
1949年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图所示:呈V型,键角116.5°.三个O原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)-三个O原子均等地享有这4个电子.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )及一个氯原子,写出其结构简式并命名.
)及一个氯原子,写出其结构简式并命名.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
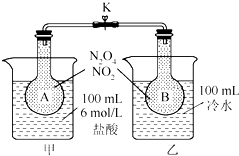 如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间止水夹K夹紧,烧杯甲中盛放100mL 6mol/L的HCl的溶液中放入25gNaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解.
如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间止水夹K夹紧,烧杯甲中盛放100mL 6mol/L的HCl的溶液中放入25gNaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com