
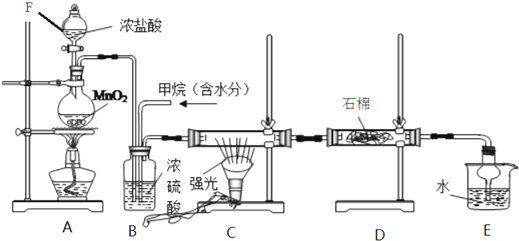
分析 装置A中用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经装置B中的浓硫酸干燥后,进入装置C中,和装置B中通入的甲烷在光照条件下在装置C中发生取代反应,生成多种氯代烃和HCl,发生的反应有CH4+4Cl2 $\stackrel{光照}{→}$CCl4+4HCl等,氯气具有强氧化性,能将碘化钾氧化为碘单质,通过装置D中石棉上的KI吸收氯气,最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离,
(1)有连接的实验装置在实验前必须检验装置气密性;
(2)反应开始进行浓盐酸在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒为炭黑,说明有碳生成;
(3)B装置中甲烷和氯气在此处混合,且浓硫酸具有吸水性;
(4)E装置中盛有水,水能吸收HCl,且倒置的干燥管能防止倒吸;
(5)氯气的物质的量越多,甲烷的转化率越大;
(6)互不相溶的液体采用分液方法分离;该装置中气体除了HCl外还有甲烷和一氯甲烷;
(7)氯气具有强氧化性,能氧化KI生成碘.
解答 解:装置A中用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经装置B中的浓硫酸干燥后,进入装置C中,和装置B中通入的甲烷在光照条件下在装置C中发生取代反应,生成多种氯代烃和HCl,发生的反应有CH4+4Cl2 $\stackrel{光照}{→}$CCl4+4HCl等,氯气具有强氧化性,能将碘化钾氧化为碘单质,通过装置D中石棉上的KI吸收氯气,最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离,
(1)有连接的实验装置在实验前必须检验装置气密性,否则可能无法实现实验目的,故答案为:检验装置气密性;
(2)CH4与Cl2在强光照射下生成的四氯甲烷和氯化氢等,可发生CH4+4Cl2 $\stackrel{光照}{→}$CCl4+4HCl等,
故答案为:CH4+4Cl2 $\stackrel{光照}{→}$CCl4+4HCl;
(3)B装置中甲烷和氯气在此处混合而使气体混合均匀,且浓硫酸具有吸水性,能干燥气体,
故答案为:使气体混合均匀;干燥气体;
(4)E装置中盛有水,水能吸收HCl,HCl能污染空气,所以E的作用是吸收HCl,且倒置的干燥管能防止倒吸,故答案为:CD;
(5)氯气的物质的量越多,甲烷的转化率越大,则理论上欲获得最多的氯化氢,x的取值范围是≥4,
故答案为:≥4;
(6)互不相溶的液体采用分液方法分离,所以装置E中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为分液;该装置中气体除了HCl外还有甲烷和一氯甲烷,为防止污染空气,应该有尾气处理装置,
故答案为:分液;AB;
(7)氯气具有强氧化性,能氧化KI生成碘,从而除去氯气,故答案为:除去过量的氯气.
点评 本题考查物质制备,为高频考点,明确甲烷发生取代反应的原理是解本题关键,知道各个装置的作用,会对装置进行实验评价,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.80 | 25.30 |
| 2 | V | 6.00 | 31.35 | 25.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
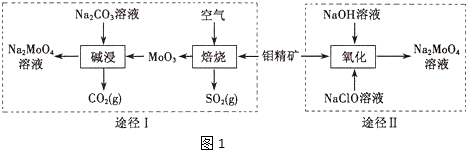
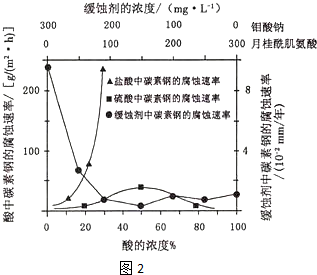
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
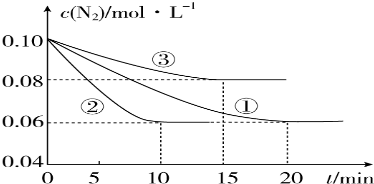
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
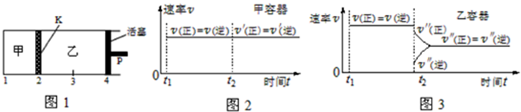
| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中 C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
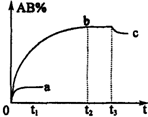 反应A2+B2?2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况.则下列叙述正确的是( )
反应A2+B2?2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况.则下列叙述正确的是( )| A. | A2、B2及AB均为气体,Q>0 | |
| B. | AB为气体,A2、B2中至少有一种为非气体,Q<0 | |
| C. | AB为气体,A2、B2中有一种为气体,Q<0 | |
| D. | AB为固体,A2、B2中有一种为非气体,Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体不均一、不稳定,静置后易产生沉淀,溶液均一、稳定、静置不产生沉淀 | |
| B. | 溶液和胶体都是纯净物,浊液是混合物 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 只有胶状物如胶水、果冻类的物质才能称为胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com