
【题目】硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)—炭粉还原法,其流程示意图如下:

(1)若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为____。
(2)上述流程中采用稀碱液比用热水更好,理由是___________。
(3)常温下,取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)=___mol·L-1。
(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示)。为使除汞效果最佳,应控制的条件是:x=___,pH控制在___范围。

②某毛纺厂废水中含0.001 mol·L-1的硫化钠,与纸张漂白后的废水(含0.002 mol·L-1NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有_____。
(5)常温下利用Fe2+、Fe3+的相互转化,可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为___________。
【答案】3Na2SO4+8C![]() 3Na2S+4CO2↑+4CO↑ 热水会促进Na2S水解,而稀碱液能抑制Na2S水解 4×10-36 mol·L-1 12 9~10 SO42-、Cl- 2Fe3+ + SO2 + 2H2O=2Fe2+ + SO42- + 4H+
3Na2S+4CO2↑+4CO↑ 热水会促进Na2S水解,而稀碱液能抑制Na2S水解 4×10-36 mol·L-1 12 9~10 SO42-、Cl- 2Fe3+ + SO2 + 2H2O=2Fe2+ + SO42- + 4H+
【解析】
(1)若煅烧所得气体为等物质的量的CO和CO2,则根据原子守恒可知煅烧时发生的总的化学反应方程式为3Na2SO4+8C![]() 3Na2S+4CO2↑+4CO↑。
3Na2S+4CO2↑+4CO↑。
(2)硫化钠是强碱弱酸盐,硫离子水解溶液显碱性,热水会促进Na2S水解,而稀碱液能抑制Na2S水解,所以上述流程中采用稀碱液比用热水更好。
(3)根据硫化铜和氢氧化铜的溶度积常数可知c(Cu2+)·c(S2-)=8.8×10-36、c(Cu2+)·c2(OH-)=2.2×10-20,所以溶液中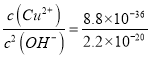 。又因为pH=4,则c(OH-)=1×10-10mol/L,所以溶液中c(S2-)=4×10-36 mol·L-1。
。又因为pH=4,则c(OH-)=1×10-10mol/L,所以溶液中c(S2-)=4×10-36 mol·L-1。
(4)①根据图像可知在pH相等的条件下x=12时汞的去除率最高。而在x值相等的条件下pH在9~10之间时汞的去除率最高。即为使除汞效果最佳,应控制的条件是:x=12,pH控制在9~10范围。
②次氯酸钠与硫化钠的物质的量之比时0.002×2:0.001×1=4:1,次氯酸钠的还原产物是氯化钠,则根据电子得失守恒可知硫化钠的氧化产物是硫酸钠,因此处理后的废水中所含的主要阴离子有SO42-、Cl-。
(5)其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则利用总反应式减去该反应即可得到另一反应的离子方程式为2Fe3+ + SO2 +2H2O=2Fe2+ + SO42- + 4H+。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】用辉铜矿(主要成分为![]() ,含少量
,含少量![]() 、
、![]() 等杂质)制备难溶于水的碱式碳酸铜的流程如图所示:
等杂质)制备难溶于水的碱式碳酸铜的流程如图所示:

(1)下列措施无法加快浸取速率的是________(填字母)。
A.延长浸取时间 B.将辉铜矿粉碎 C.充分搅拌 D.适当增大硫酸浓度
(2)滤渣Ⅰ中的主要成分是![]() 、S、
、S、![]() ,请写出“浸取”反应中生成S的离子方程式:_________________________。
,请写出“浸取”反应中生成S的离子方程式:_________________________。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,原因可能是__________________________。
(4)“沉锰”(除![]() )过程中有关反应的离子方程式为________________________________。
)过程中有关反应的离子方程式为________________________________。
(5)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式如下图,下列说法不正确的是
![]()
A. 咖啡酸可以发生取代、加成、氧化、酯化、加聚反应
B. 1mol 咖啡酸最多能与5 mol H2反应
C. 咖啡酸分子中所有原子可能共面
D. 蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种一元醇A,则醇A 的分子式为C8H10O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 X、Y、Z、W 的原子序数依次增加。m、p、r 是由这些元素组成的二元化合物,n 是 W 的单质,q 是 Y 的单质,s 是 Z 的单质且常温下为淡黄色固体,m 与 r 相遇会产生白烟。上述物质的转化关系如图所示。下列说法不正确的是( )
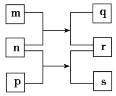
A.原子半径:Z>W>X
B.Y 的一种氢化物可作为火箭的燃料
C.Z 的氧化物对应的水化物酸性一定比 W 的弱
D.X、Y、W 三种元素组成的化合物可为离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A元素次外层电子数是最外层电子数的![]() ,其外围电子轨道表示式是__。
,其外围电子轨道表示式是__。
(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是__,在元素周期表中的位置是__,位于周期表___区,写出基态B原子的核外电子排布式___。
(3)C、N、O、F四种元素第一电离能由大到小的顺序为___,电负性由大到小的顺序为___。
(4)基态Fe2+核外电子排布式为__,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为__。
(5)根据元素As在周期表中的位置预测As的氢化物分子的空间构型为__,其沸点比NH3的__(填“高”或“低”),其判断理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置(略去部分夹持仪器,气密性已检验)生产硫代硫酸钠晶体(Na2S2O3·5H2O)。实验步骤是先向装置①的烧瓶中滴加80%的浓H2SO4;充分反应后过滤装置③中混合物,滤液经结晶即得到产品。

已知:2Na2S+Na2SO3+3SO2=3Na2S2O3。下列判断不正确的是( )
A.应用装置①,利用H2O2和MnO2可制备少量O2
B.装置③中Na2S和Na2SO3的物质的量之比最好为1:2
C.实验过程中,装置②和装置④的作用相同
D.装置⑤中盛有NaOH溶液,可吸收多余的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用pH传感器进行数字化实验,分别向两个盛50mL0.100mol/L盐酸的烧杯中匀速滴加50mL去离子水、50mL0.100mol/L 醋酸铵溶液,滴加过程进行磁力搅拌,测得溶液pH随时间变化如图所示。已知常温下醋酸铵溶液pH=7,下列说法错误的是
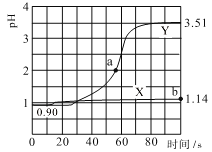
A.曲线X表示盐酸中加醋酸铵溶液稀释的pH变化
B.曲线Y的pH变化主要是因为CH3COO-与H+结合成了弱电解质
C.a点对应的溶液中c(Cl-)+c(CH3COO-)+c(CH3COOH)-c(NH4+)=0.01mol/L
D.b点对应的溶液中水电离的c(H+)=10-12.86 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯催化脱氢制苯乙烯反应:

下列说法中不正确的是( )
A. 乙苯的一氯代物共有3种不同结构
B. 苯乙烯和氢气生成乙苯的反应属于加成反应
C. 苯乙烯分子中所有原子有可能位于同一平面上
D. 等质量的苯乙烯和聚苯乙烯燃烧耗氧量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧(![]() )在
)在![]() 催化下能将烟气中的
催化下能将烟气中的![]() 、
、![]() 分别氧化为
分别氧化为![]() 和
和![]() ,
,![]() ,也可在其他条件下被还原为
,也可在其他条件下被还原为![]() 。
。
(1)![]() 中心原子轨道的杂化类型为__________;
中心原子轨道的杂化类型为__________;![]() 的空间构型为__________(用文字描述)。
的空间构型为__________(用文字描述)。
(2)与![]() 分子互为等电子体的一种阴离子为__________(填化学式)。
分子互为等电子体的一种阴离子为__________(填化学式)。
(3)![]() 分子中
分子中![]() 键与
键与![]() 键的数目比
键的数目比![]() __________。
__________。
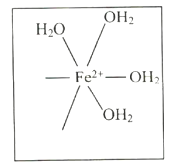
(4)![]() 与
与![]() 反应生成的
反应生成的![]() 中,
中,![]() 以
以![]() 原子与
原子与![]() 形成配位键。请在
形成配位键。请在![]() 结构示意图的相应位置补填缺少的配体_________。
结构示意图的相应位置补填缺少的配体_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com