
| A. | ②③ | B. | ②③④ | C. | ①②③④ | D. | ③④ |
分析 两种短周期元素组成的化合物中原子数比为1:3,则化学式为AB3型,可能为第ⅢA族与ⅥⅠA组元素组成、可能为第ⅤA族和ⅥⅠA族元素组成、还可能为NH3或SO3,注意C2H6中原子数比为1:3,然后分析原子序数的关系.
解答 解:两种短周期元素组成的化合物中原子数比为1:3,则化学式为AB3型,
两种元素的原子序数分别是a和b,
若为C2H6,则6=1+5,故①可能;
若为AlCl3,则13+17=30,故②可能;
若为NH3,则7+1=8,故③可能;
若为SO3,则16=8+8,故④可能;
显然①②③④都可能,故选C.
点评 本题考查化合物中原子序数的关系,明确常见的AB3型的化合物是解答本题的关键,本题中C2H6为学生思考容易遗漏的问题.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性, |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
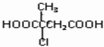 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:(RCH3CH=CH2+HCl$\stackrel{催化剂}{→}$RCH3CHClCH3)
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:(RCH3CH=CH2+HCl$\stackrel{催化剂}{→}$RCH3CHClCH3)  .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X元素的氢化物的水溶液显碱性 | |
| B. | Z元素的离子半径大于W元素的离子半径 | |
| C. | Z元素的单质在一定条件下能与X元素的单质反应 | |
| D. | Y元素的氧化物是含有极性键的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室制取乙烯的装置如下图所示,请回答:
实验室制取乙烯的装置如下图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁与二氧化碳反应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 木炭在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

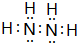 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸的电离:CH3COOH?CH3COO-+H+ | |
| B. | 纯水中水的电离:2H2O?H3O++OH- | |
| C. | 氢硫酸的电离:H2S?2H++S2- | |
| D. | 氯化铁和硫氰化钾反应:Fe3++3SCN-?Fe(SCN)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com