
| A. | 原子半径:A<D<C<B | |
| B. | 最简单氢化物的稳定性:D<C | |
| C. | A与C形成的化合物溶于水所得溶液显碱性 | |
| D. | B与D形成的化合物溶于水所得溶液显碱性 |
分析 短周期主族元素A、B、C、D原子序数依次增大,B原子最外层电子数等于A原子最外层电子数的一半,则A原子最外层电子数为偶数,A、C的原子序数的差为8,则A、C为同主族元素,A、B、C三种元素原子的最外层电子数之和为15,令B原子最外层电子数为x,则x+2x+2x=15,解的x=3,故A、C的最外层电子数为6,A为O元素,C为S元素,B的原子序数大于氧元素,最外层电子数为3,故B为Al元素,D的原子序数最大,故D为Cl元素,以此解答该题.
解答 解:短周期主族元素A、B、C、D原子序数依次增大,B原子最外层电子数等于A原子最外层电子数的一半,则A原子最外层电子数为偶数,A、C的原子序数的差为8,则A、C为同主族元素,A、B、C三种元素原子的最外层电子数之和为15,令B原子最外层电子数为x,则x+2x+2x=15,解的x=3,故A、C的最外层电子数为6,A为O元素,C为S元素,B的原子序数大于氧元素,最外层电子数为3,故B为Al元素,D的原子序数最大,故D为Cl元素,
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Al>S>Cl>O,即A<D<C<B,故A正确;
B.同周期自左而右非极性增强,非金属性Cl>S,非金属性越强,氢化物越稳定,故稳定性HCl>H2S,故B错误;
C.A为O元素,C为S元素,形成的化合物为二氧化硫或三氧化硫,溶液呈酸性,故C错误;
D.B为Al元素,D为Cl元素,形成的化合物为氯化铝,水解呈酸性,故D错误.
故选A.
点评 本题考查结构位置性质关系,难度中等,注意利用奇偶性及A、C的原子序数相差8判断二者处于同一主族(短周期),是推断元素关键.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 发生铅中毒时,可喝大量的牛奶或鸡蛋清来缓解病情 | |
| B. | CO2的水溶液呈酸性,CO2的大量排放会导致酸雨的形成 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
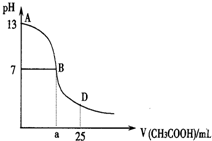 如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )| A. | c(OH-)大于、小于或等于c(CH3COO-) | B. | c(OH-)一定等于c(CH3COO-) | ||
| C. | c(OH-)一定小于c(CH3COO-) | D. | c(OH-)一定大于c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
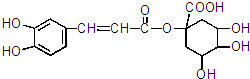 所示:
所示: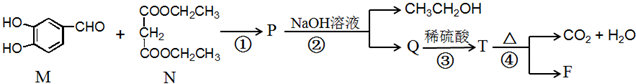

 .
.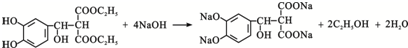 .
.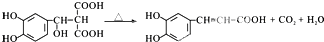 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2固体中含离子总数为3NA | |
| B. | 0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| C. | 40g NaOH溶于1L水中,所得NaOH 溶液的物质的量浓度为1mol/L | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:
天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:时间 物质 | 0min | 20min | 60min | 90min | 120min |
| H2S | 0.006 | 0.005 | |||
| H2 | 0 | 0.002 | 0.004 | ||
| S2 | 0 | 0.002 | 0.0025 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com