
分析 根据V=nVm可知,同温同压下,气体的物质的量与体积成正比,据此计算出二者的物质的量之比;先计算出二者的平均摩尔质量,然后根据相同条件下摩尔质量与密度成正比计算出混合气体与氢气的相对密度.
解答 解:相同条件下,气体摩尔体积相同,根据V=nVm可知,气体的物质的量与体积成正比,则氢气和二氧化碳的物质的量之比为5.6L:11.2L=1:2;
该混合气体的平均摩尔质量为:$\frac{2×1+44×2}{3}$g/mol=30g/mol,根据M=ρVm可知,相同条件下气体的密度与摩尔质量成正比,所以同温同压下该混合气体密度是H2的$\frac{30g/mol}{2g/mol}$=15倍,
故答案为:1:2;15.
点评 本题考查了物质的量的计算,题目难度不大,明确摩尔质量与密度的关系为解答关键,注意熟练掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
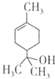
| A. | 1mol该物质最多能和lmol氢气发生加成反应 | |
| B. | 该物质属于烃的衍生物 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C10H20O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4 | |
| B. | 硅处于金属与非金属的过渡位置,硅可用作半导体材料 | |
| C. | 由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
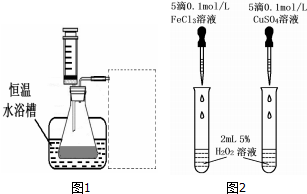
| 所需试剂 | 操作及现象 | 结论 |
| Cl对H2O2分解无催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.
它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com