
常温下,将Na2CO3和NaHCO3混合物〔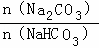 =a a≤3〕溶于水制得稀溶液,下列有关该溶液中微粒的物质的量浓度关系正确的是( )
=a a≤3〕溶于水制得稀溶液,下列有关该溶液中微粒的物质的量浓度关系正确的是( )
|
| A. | a=1则c(CO32﹣)>c(HCO3﹣)>c(OH﹣)>c(H+) |
|
| B. | a=2则c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3) |
|
| C. | a为任意值时,则c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣) |
|
| D. | a=0则c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+) |
| 离子浓度大小的比较. | |
| 专题: | 盐类的水解专题. |
| 分析: | A.a=1时,碳酸根离子的水解程度大于碳酸氢根离子,则溶液中c(CO32﹣)<c(HCO3﹣); B. C.溶液中一定满足电荷守恒,根据混合液中的电荷守恒判断; D.a=0时,碳酸钠的物质的量为0,该溶液为碳酸氢钠溶液,根据碳酸氢钠溶液中的离子浓度大小判断. |
| 解答: | 解:A.a=1,碳酸氢钠与碳酸钠的物质的量相等,由于碳酸根离子的水解程度大于碳酸氢根离子,则c(CO32﹣)<c(HCO3﹣),溶液中离子浓度大小关系为:c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+),故A错误; B.溶液中存在电荷守恒c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣),存在物料守恒3c(Na+)=5c(CO32﹣)+5c(HCO3﹣)+5c(H2CO3),则3c(OH﹣)=3c(H+)+2c(HCO3﹣)+5c(H2CO3)+2c(CO32﹣),故B错误; C.a为任意值时,溶液中一定满足电荷守恒,根据电荷守恒可得:c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣),故C正确; D.. 故选C. |
| 点评: | 本题考查了溶液中离子浓度大小比较,题目难度中等,注意掌握判断溶液中离子浓度大小比较的方法,明确电解原理及其应用方法,还要注意电荷守恒、物料守恒的含义及其应用,试题培养了学生的分析、理解能力及灵活应用所学知识的能力. |


科目:高中化学 来源: 题型:
下列日常生活中的现象与氧化还原反应无关的是
A.铜铸塑像上出现铜绿[Cu2(OH)2CO3] B.用石膏点豆腐
C.不良商贩用硫黄熏蒸法制作“白豆芽” D.自来水厂用氯气对水进行消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 难溶电解质的Ksp越小,溶解度就一定越小 |
|
| B. | 一般认为沉淀离子浓度小于1.0×10﹣5 mol/L时,沉淀就达完全 |
|
| C. | 用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) |
|
| D. | 向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作和说法正确的是( )
|
| A. | 用pH试纸检验气体的酸碱性时,一定要先用蒸馏水润湿 |
|
| B. | 润洗滴定管:从滴定管上口加入所要盛装的酸或碱溶液至“0”刻线,再将液体从滴定管下部放出,重复操作2~3次 |
|
| C. | 用瓷坩埚加热熔化碳酸钠固体 |
|
| D. | Mg和Al分别为电极,插入NaOH溶液中,构成原电池,探究Mg、Al的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3是工业生产中的重要化工原料,也是高中化学非常重要的化合物,高考的热点内容.
(1)请写出实验室制取NH3的化学方程式 Ca(OH)2+2NH4Cl  CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)为了快速得到大量的NH3,可通过浓氨水和固体氧化钙作用获得,分析其中的原因 氨水中存在NH3+H2O⇌NH3.H2O⇌NH4++OH﹣氧化钙溶水产生大量OH﹣,使平衡逆向进行有利于NH3放出.同时氧化钙溶水放出大量热,使气体溶解度下降,有利于NH3放出.
多余 (用离子方程式和简要的文字说明)
(3)用排空气法收集到的氨气是相同条件下氢气密度的10.5倍,用此氨气做喷泉实验,液体上升到容器容积的  ,若外界条件为标准状况,所得氨水的物质的量浓度为 0.045mol/L .
,若外界条件为标准状况,所得氨水的物质的量浓度为 0.045mol/L .
(4)科学家利用氨气在纯氧中燃烧,可生成N2和水的原理.设计成NH3﹣O2燃料电池,碱性条件下该电池负极电极反应为: 2NH3+6OH﹣﹣6e﹣=N2+6H2O .
查看答案和解析>>
科目:高中化学 来源: 题型:
关于如图所示装置的下列叙述,正确的是( )
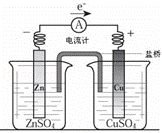
|
| A. | 电流方向是从锌片经导线流向铜片 |
|
| B. | 锌是阳极,锌片上有大量气泡产生 |
|
| C. | 铜离子在铜片表面被氧化,质量逐渐增大 |
|
| D. | 盐桥作用主要是离子通道和保持溶液电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl﹣的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.
(1)写出该反应的离子方程式 .
(2)反应开始时反应速率加快的原因是 .
(3)反应后期反应速率减慢的原因是 .

查看答案和解析>>
科目:高中化学 来源: 题型:
欲除去下列物质中混入的少量杂质(括号内物质为杂质),错误的是( )
A. 乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液
B. 乙醇(水):加入新制生石灰,蒸馏
C. 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液
D. 乙酸(乙醇):加入金属钠,蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com