
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
分析 根据价层电子对互斥理论确定分子的空间构型,分子中中心原子价层电子对个数=σ个数+孤电子对个数,如果价层电子对个数是4且不含孤电子对,则为正四面体结构,如果价层电子对个数是4且含有一个孤电子对,则为三角锥形结构,如果价电子对个数是4且含有2个孤电子对,则为V形,据此分析解答.
解答 解:H2S中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4且含有2个孤电子对,所以其立体结构为V形;
PCl3中价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4且含有1个孤电子对,所以其立体结构为三角锥形,
故选B.
点评 本题考查了分子空间构型的判断,为高考高频点,根据价层电子对互斥理论分析解答即可,注意孤电子对个数的计算方法,为易错点.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素符号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| A. | 14X可用与测定文物年代 | B. | Z的非金属性比T强 | ||
| C. | Y和T位于同一主族 | D. | X元素形成的化合物种类很多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强(对于气体反应),活化分子总数必然增大,故反应速率增大 | |
| B. | 温度升高,分子动能增加,减小了活化能,故反应速率增大 | |
| C. | 选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大 | |
| D. | H+和OH-的反应活化能非常小,反应几乎在瞬间完成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
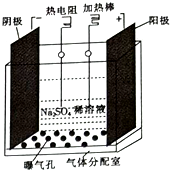 过氧化氢是实验室常用的试剂,在医疗、军事及工业上用途也非常广泛.回答下列问题:
过氧化氢是实验室常用的试剂,在医疗、军事及工业上用途也非常广泛.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaNO3溶液 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量蒸馏水 | D. | 改用98%的浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
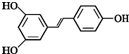 .根据要求回答下列问题:
.根据要求回答下列问题: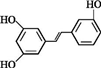 .
.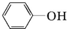 )都含有与白藜芦醇相同的官能团,有关它们之间关系的说法正确的是C.
)都含有与白藜芦醇相同的官能团,有关它们之间关系的说法正确的是C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲基(-CH3)含有的电子数目为9NA | |
| B. | 28g乙烯和丙烯的混合气体中所含碳原子数为2NA | |
| C. | 1mol乙醛与足量新制Cu(OH)2悬浊液反应,转移电子数目为NA | |
| D. | 25℃时,1mol己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
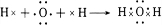 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com