
【题目】实验中需0.5 mol/L的NaOH溶液240 ml,配制时应选用容量瓶的规格和称取NaOH的质量分别是 ( )
A、240 ml ,4.8 g B、250 ml ,5.0 g
C、500 ml ,10.0 g D、任意规格,4.8 g
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl﹣、Br﹣
B.常温下 ![]() =12的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
=12的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
C.含有大量Al3+的溶液中:Na+、Cl﹣、AlO2﹣、OH﹣
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42﹣、S2﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①相同温度下,同浓度的5中溶液中,水的电离程度的大小顺序为:E=B>C>A=D
②B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
③浓度均为0.1mol·L-1 C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是___________,E是___________;
(2)用水稀释0.1mol·L-1 B溶液时,溶液中随着水量的增加而减小的是_________(填写序号)
a. ![]() b.
b. ![]() c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是_____________(填写序号)。
a.反应所需要的时间E>A b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E d.E溶液里有镁粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中________曲线(填写序号)。
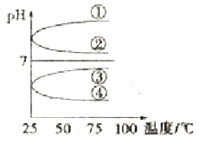
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰实验室里从紫菜中提取碘的流程如图1: 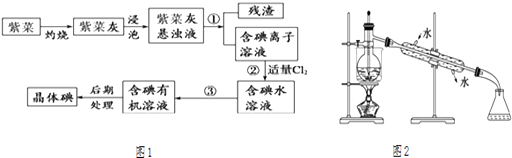
(1)实验室焙烧紫菜,需要下列仪器中的(填序号).
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:① , ③ .
(3)提取碘的过程中,可选择的有机试剂是
A.酒精 B.苯 C.乙酸 D.食盐水
选择该试剂的理由是 .
(4)为使紫菜灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有、 .
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,观察图2中的实验装置图改正其中的错误之处:
①;②;③ .
(6)进行上述蒸馏操作时,使用水浴加热,最后晶态碘在里聚集.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH ![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5:1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A. 乙烯、聚乙烯和苯分子中均含有碳碳双键
B. 苯、油脂均不能使酸性高锰酸钾溶液褪色
C. 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
D. 甲烷和Cl2的反应与乙烯和Br2的反应不属于同一类型的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰实验室里从紫菜中提取碘的流程如图1: 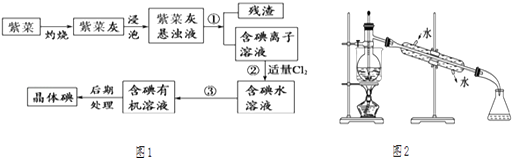
(1)实验室焙烧紫菜,需要下列仪器中的(填序号).
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:① , ③ .
(3)提取碘的过程中,可选择的有机试剂是
A.酒精 B.苯 C.乙酸 D.食盐水
选择该试剂的理由是 .
(4)为使紫菜灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有、 .
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,观察图2中的实验装置图改正其中的错误之处:
①;②;③ .
(6)进行上述蒸馏操作时,使用水浴加热,最后晶态碘在里聚集.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠﹣过氧化氢加合物(xNa2SO4yH2O2zH2O)的组成可通过下列实验测定:①准确称取1.7700g样品,配制成100.00mL溶液A.②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g.③准确量取25.00mL溶液A,加适量稀硫酸酸化后,用0.02000molL﹣1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00mL.H2O2与KMnO4反应的离子方程式如下:2MnO4﹣+5H2O2+6H+=2Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10﹣10 , 欲使溶液中c(SO42﹣)≤1.0×10﹣6 molL﹣1 , 应保持溶液中c(Ba2+)≥molL﹣1 .
(2)上述滴定若不加稀硫酸酸化,MnO4﹣被还原为MnO2 , 其离子方程式为
(3)上述滴定到达终点的现象为
(4)通过计算确定样品的组成(写出计算过程).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com