
| A. | 3:2:1 | B. | 2:6:3 | C. | 3:6:2 | D. | 2:1:3 |
科目:高中化学 来源: 题型:解答题
 ;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.
;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl2═CH2 | B. | CH3-CH═CH2 | C. | CH3-CH═CH-CH3 | D. | CH2═CH-CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示氯化氢分子的形成过程: | |
| B. | 一定条件下从正反应开始的某可逆反应达到化学平衡时,正反应速率降到最小 | |
| C. | 酸与碱发生中和反应时放出的热量叫中和热 | |
| D. | 催化剂不但能改变反应速率,也能改变反应进行的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
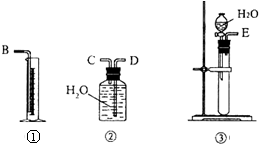 现有含CaO杂质的CaC2试样.某研究性学习小组的同学用图中的装置,设计一个实验,测定CaC2试样的纯度.
现有含CaO杂质的CaC2试样.某研究性学习小组的同学用图中的装置,设计一个实验,测定CaC2试样的纯度.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 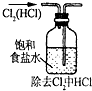 | B. |  | C. | 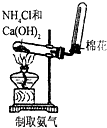 | D. | 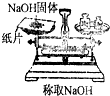 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com