
合成氨反应N2(g)+3H2(g) 2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
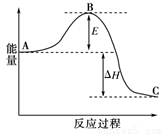
请回答下列问题:
(1)该反应通常用铁作催化剂,加催化剂会使图中E变_____(填“大”或“小”),E的大小对该反应的反应热有无影响?_ _。理由是_________ ;
(2)图中ΔH=________kJ·mol-1;
(3)起始充入2mol·L-1 N2和5.5 mol·L-1 H2 ,经过50 min,NH3的浓度为1mol·L-1,
则v(N2)=____________mol·L-1·min-1、C(H2)=______________mol·L-1;
已知NH3(g)= NH3 (l) ΔH=-QkJ·mol-1,书写N2(g)+3H2(g)=2NH3 (l)的热化学方程式 ________ 。
(1)小,无。△H取决于反应物的总能量和生成物的总能量差;(2)-92.2 (3)0.01 4
(4)N2(g) + 3H2(g) ⇋ 2NH3(g) ΔH=-(92.2+Q)kJ·mol-1
【解析】
试题分析:(1)用铁作催化剂可以降低反应活化能E,所以加催化剂会使图中E变变小;△H取决于反应物的总能量和生成物的总能量差,所以E的大小对该反应的反应热没有影响。
(2)NH3的物质的量为17g/17g·mol-1=1mol △H=2×-46.1 kJ=-92.2 kJ(该反应为放热反应,符号为负)
(3)NH3的变化浓度为1mol·L-1时,根据反应比,N2的浓度变化了0.5mol·L-1,v(N2)=0.5mol·L-1/50 min=0.01 mol·L-1;NH3的变化浓度为1mol·L-1时,根据反应比,H2的浓度变化了1.5 mol·L-1,C(H2)=5.5 mol·L-1-1.5 mol·L-1=4 mol·L-1
(4)N2(g) + 3H2(g) ⇋ 2NH3(g) ΔH=-(92.2+Q)kJ·mol-1
考点:本题着重考查了化学反应热、化学反应速率计算的相关知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 2 |
- 6 |
+ 2 |
- 6 |
+ 4 |
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 =PtF6-(g)△H2=-771.1kJ?mol-1
=PtF6-(g)△H2=-771.1kJ?mol-1| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(H2)=0.1mol/(L?s) | B、v(N2)=0.1mol/(L?s) | C、v(N2)=0.2mol/(L?s) | D、v(NH3)=0.3mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0 | B、氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转换率高 | C、合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0,加入催化剂能加快反应速率并提高转化率 | D、25℃Ksp[Al(OH)3]=2×10-33,Ksp(AlPO4)=1.310-20,在各自的饱和溶液中,c(Al3+)前者小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com