
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
![]() 航天领域中常用
航天领域中常用![]() 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。![]() 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱![]() 用电离方程式表示
用电离方程式表示![]() 显碱性的原因是:________________。
显碱性的原因是:________________。
![]() 在恒温条件下,
在恒温条件下,![]() 和足量C发生反应
和足量C发生反应![]() ,测得平衡时
,测得平衡时![]() 和
和![]() 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
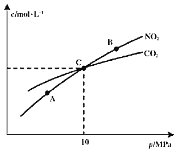
![]() 、B两点的浓度平衡常数关系:
、B两点的浓度平衡常数关系:![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() 、B、C三点中
、B、C三点中![]() 的转化率最高的是______
的转化率最高的是______![]() 填“A”或“B”或“C”
填“A”或“B”或“C”![]() 点。
点。
![]() 计算C点时该反应的压强平衡常数
计算C点时该反应的压强平衡常数![]() ______
______![]() 是用平衡分压代替平衡浓度计算,分压
是用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 已知:亚硝酸
已知:亚硝酸![]() 性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数
性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数![]() ;
;![]() 的
的![]() ,
,![]() 在常温下向含有2mol碳酸钠的溶液中加入1mol的
在常温下向含有2mol碳酸钠的溶液中加入1mol的![]() 后,则溶液中
后,则溶液中![]() 、
、![]() 和
和![]() 的离子浓度由大到小的顺序是______。
的离子浓度由大到小的顺序是______。
![]() 已知:常温下甲胺
已知:常温下甲胺![]() 的电离常数为
的电离常数为![]() ,且
,且![]() 水溶液中有
水溶液中有![]() ,常温下向
,常温下向![]() 溶液滴加稀硫酸至
溶液滴加稀硫酸至![]() 时,则溶液
时,则溶液![]() ______。
______。
![]() 一种煤炭脱硫技术可以把硫元素以
一种煤炭脱硫技术可以把硫元素以![]() 的形成固定下来,但产生的CO又会与
的形成固定下来,但产生的CO又会与![]() 发生化学反应,相关的热化学方程式如下:
发生化学反应,相关的热化学方程式如下:![]()
![]()
![]() ,反应
,反应![]() ______
______![]()
【答案】N2![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
(1)N2H4易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为:N2H4·H2O![]() N2H5++OH-;
N2H5++OH-;
(2)①平衡常数只受温度影响,所以Kc(A)=Kc(B);
②增大压强平衡向气体体积减小的方向移动,该反应的正反应是气体体积增大的反应,所以A、B、C三点中NO2的转化率最高的是A点;
③在C点时,CO2与NO2的浓度相等,根据反应2NO2(g)+2C(s)![]() N2(g)+2CO2(g),可知N2的浓度为CO2的一半,所以混合气体中CO2的体积分数为
N2(g)+2CO2(g),可知N2的浓度为CO2的一半,所以混合气体中CO2的体积分数为![]() ,NO2的体积分数
,NO2的体积分数![]() ,N2的体积分数
,N2的体积分数![]() ,所以反应的压强平衡常数KP=
,所以反应的压强平衡常数KP=![]() =
= MPa=2MPa;
MPa=2MPa;
(3)由HNO2的电离平衡常数Ka=5.1×10-4,H2CO3的Ka1=4.2×10-7,Ka2=5.61×10-11,可知溶液中完全反应生成等物质的量的Na2CO3、NaHCO3和NaNO2,可判断水解程度大小顺序为CO32->HCO3->NO2-,CO32-水解生成HCO3-,所以溶液中CO32-、HCO3-和NO2-的浓度大小关系为:c(HCO3-)> c(NO2-)> c(CO32-);
(4)CH3NH2+H2O![]() CH3NH3++OH-的Kb=
CH3NH3++OH-的Kb=![]() ,向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,Kb=c(OH-)=10-3.4mol/L,c(H+)=
,向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,Kb=c(OH-)=10-3.4mol/L,c(H+)=![]() =10-10.6mol/L,pH=10.6;
=10-10.6mol/L,pH=10.6;
(5)由盖斯定律可知将②-①可得△H=-189.2kJ·mol-1-(+210.5kJ·mol-1)=-399.7kJ·mol-1,则CaO(s)+3CO(g)+SO2(g)![]() CaS(s)+3CO2(g) △H=-399.7kJ·mol-1。
CaS(s)+3CO2(g) △H=-399.7kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
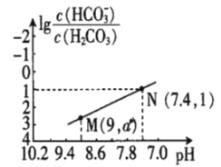
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1的平衡常数为K1;
反应②Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2的平衡常数为K2。
反应③CO2(g)+H2(g)CO(g)+H2O(g) ΔH3的平衡常数为K3。
不同温度时K1、K2的值如下表,下列说法正确的是 ( )
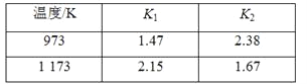
A.K3=K1-K2
B.K3=K1+K2
C.ΔH3>0
D.ΔH3<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:

下列说法正确的是( )
A. 反应1→2属于加成反应,且生成的化合物2具有一个手性碳原子
B. 化合物2在一定条件下可发生消去反应
C. 检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
D. 等物质的量四种化合物分别与足量NaOH反应,消耗NaOH物质的量之比为1:3:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2+O2![]() 2SO3,△H<0下列措施能使反应物中活化分子百分数、化学平衡状态都发生变化的是( )
2SO3,△H<0下列措施能使反应物中活化分子百分数、化学平衡状态都发生变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)![]() cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
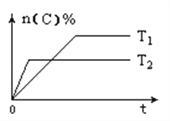

A. 升高温度,平衡向正反应方向移动 B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a<c+d D. 根据图象无法确定改变温度后平衡移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体。
(1)写出下列元素的名称 X_______,Y________,Z__________
(2)X—H键和Y—H键属于极性共价键,其中极性较强的是________(X、Y用元素符号表示)键。X的第一电离能比Y的________(填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:________________。
(4)W的基态原子的价电子排布式为____________;
(5)Y元素的核外电子轨道表示式为___________。
(6)已知一种Y4分子结构如图所示:

断裂1 mol Y—Y键吸收167 kJ的热量,生成1 mol Y≡Y放出942 kJ热量。则由1molY4气态分子变成2molY2气态分子_______(填写吸收或放出)_______kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将图1所示装置中的盐桥(琼脂-饱和![]() 溶液)换成铜导线与石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转。下列说法正确的是
溶液)换成铜导线与石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转。下列说法正确的是
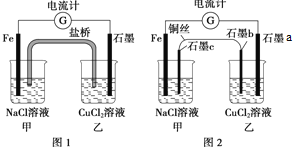
A. 图1中,铁棒质量减少5.6g,则甲池![]() 溶液的质量增加5.6g
溶液的质量增加5.6g
B. 图1中的石墨电极与图2中乙池石墨![]() 电极的电极反应式相同
电极的电极反应式相同
C. 两图所示装置的能量变化均是将化学能转化为电能
D. 图2中电子流向为![]() 电流计→石墨a→石墨b→铜丝→石墨c→
电流计→石墨a→石墨b→铜丝→石墨c→![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com