
X、Y、Z均为短周期元素,它们在周期表中的相对位置如图:

已知:X、Y、Z三元素的质子数之和为31.试完成下列问题:
(1)X原子的电子式为________.
(2)Y的最高氧化物的电子式为________.
(3)Z单质与盐酸反应的化学方程式为________.
|
答案:(1) (2) (3)2Al+6HCl 思路解析:本题是根据周期表的位置及有关数据确定元素的推断题. 首先,判断X元素位于第几周期,若X元素位于第一周期,则X为He,Z为F,但三元素质子数之和小于31,所以这种假设不成立.也不可能为第三周期,否则Y、Z就成了第四周期了,不是短周期元素.则X元素只能位于第二周期. 解法一:为组合法,三元素有如下几种组合: ①X是B,Y是Na,Z是Mg;②X是C,Y是Mg,Z是A1;③X是N,Y是A1,Z是Si;④X是O,Y是Si,Z是P;⑤X是F,Y是P,Z是S;⑥X是Ne,Y是S,Z是Cl. 其中,第①组元素质子数之和小于31,第③④⑤⑥组三元素质子数之和均大于31,故正确答案是第②组. 解法二:为代数法,设X的原子序数为a,则Y的原子序数为a+6,Z的原子序数为a+7. a+(a+6)+(a+7)=31,a=6,所以X的原子序数为6,是碳;Y的原子序数为6+6=12,是镁;Z的原子序数为6+7=13,是铝. 显然第二种方法更简单灵活. |


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
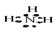
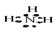
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z均为短周期元素,在元素周期表中它们的相对位置如图,已知3种元素的原子序数之和为31,下列有关叙述中正确的是( )
X、Y、Z均为短周期元素,在元素周期表中它们的相对位置如图,已知3种元素的原子序数之和为31,下列有关叙述中正确的是( )| A、Y元素为Al | B、Z的氧化物不能与强碱溶液反应 | C、原子半径大小为Y>Z>X | D、X只能形成一种氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com