
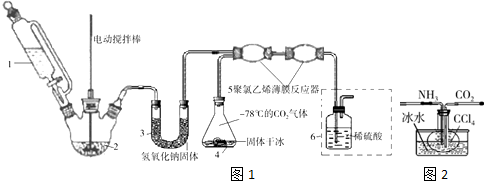
 ),有关反应、数据和实验步骤如下:
),有关反应、数据和实验步骤如下:
| 熔点/℃ | 沸点/℃ | 颜色 | 水溶性 | 相对分子质量 | |
| 对氯甲苯 | 7.5 | 162 | 无色 | 难溶 | 126.5 |
| 对氯苯甲酸 | 243 | 275 | 白色 | 微溶 | 156.5 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
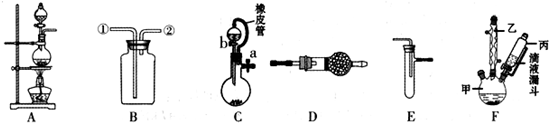
分析 (1)平衡分液漏斗与圆底烧瓶中压强,便于液体顺利流下;D干燥氨气,可以盛放碱石灰;
(2)利用装罝A和E组合实验可比较Cl2和I2的氧化性强弱,A中制备氯气,E中发生置换反应生成碘单质;
(3)在装罝B中装满水可用来收集NO,从短管通入NO,从长导管排出水;
(4)①量取6.OOmL对氯甲苯,结合量取体积精度可知应选择滴定管,且对氯甲苯容易腐蚀橡皮管;
②控制温度在93℃左右,低于水的沸点,可以采取水浴加热;
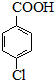
③对氯苯甲酸钾属于可溶性盐,滤液、洗涤液中含有对氯苯甲酸钾,加入稀硫酸酸化时生成对氯苯甲酸;
④根据对氯甲苯质量计算对氯苯甲酸的理论产量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)C中橡皮管可以平衡分液漏斗与圆底烧瓶中压强,便于液体顺利流下;氨气为碱性气体,D干燥氨气,可以盛放碱石灰,
故答案为:平衡分液漏斗与圆底烧瓶中压强,便于液体顺利流下;碱石灰;
(2)利用装罝A和E组合实验可比较Cl2和I2的氧化性强弱,A中制备氯气,E中发生置换反应:Cl2+2I-=2Cl-+I2,生成碘单质,四氯化碳萃取溶液中的碘,静置分层,四氯化碳层由无色变为紫红色,
故答案为:四氯化碳层由无色变为紫红色;Cl2+2I-=2Cl-+I2;
(3)在装罝B中装满水可用来收集NO,从短管通入NO,从长导管排出水,
故答案为:②;
(4)①量取6.OOmL对氯甲苯,结合量取体积精度可知应选择滴定管,且对氯甲苯容易腐蚀橡皮管,应选择酸式滴定管,
故答案为:C;
②控制温度在93℃左右,低于水的沸点,可以采取水浴加热,受热均匀,便于控制温度,
故答案为:水浴加热;
③对氯苯甲酸钾属于可溶性盐,滤液、洗涤液中含有对氯苯甲酸钾,加入稀硫酸酸化时生成对氯苯甲酸,现象是:产生白色沉淀,
故答案为:产生白色沉淀;
④由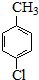 ~
~ ,可知对氯苯甲酸的理论产量为$\frac{6.42g}{126.5g/mol}$×156.5g,则对氯苯甲酸的产率为:[7.19g÷($\frac{6.42g}{126.5g/mol}$×156.5g)]×100%≈90.5%,
,可知对氯苯甲酸的理论产量为$\frac{6.42g}{126.5g/mol}$×156.5g,则对氯苯甲酸的产率为:[7.19g÷($\frac{6.42g}{126.5g/mol}$×156.5g)]×100%≈90.5%,
故选:D.
点评 本题考查有机物的制备实验、氨气的制备、气体收集、性质实验、实验基本操作等,属于拼合型题目,注意对题目信息的运用,题目难度中等.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10:7:11 | B. | 11:11:8 | C. | 11:10:8 | D. | 10:11:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:| 实验序号 | 待测液体积(ML) | 所消耗NaOH标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
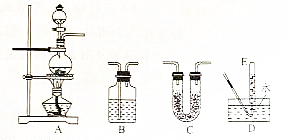
| 选用的仪器 | 加入的试剂 |
| A | 二氧化锰、浓硫酸、食盐 |
| B | 饱和食盐水 |
| B | KBr溶液和CCl4的混合液 |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
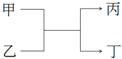 甲和丙为短周期、同主族元素组成的单质,乙和丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可能是下列各组物质中的( )
甲和丙为短周期、同主族元素组成的单质,乙和丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可能是下列各组物质中的( )| A. | H2和Na | B. | S和O2 | C. | C和Si | D. | Cl2和Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
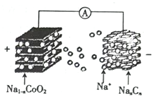 室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:
室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:| A. | 充电时,Na+向正极移动 | |
| B. | 放电时,负极的电极反应式为NaxCn-xe-=xNa++Cn | |
| C. | 充电时,阴极质量减小 | |
| D. | 充电时,阳极的电极反应式为NaCoO2-xe-=Na1-xCoO2+xNa+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com