
【题目】下列有关实验中的说法正确的是
A. 将碘水倒入分液漏斗中,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B. 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C. 某无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO![]()
D. 加浓溴水然后过滤可以除去苯中少量的苯酚
科目:高中化学 来源: 题型:
【题目】实验中需2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl的质量分别
A. 1000mL,117gB. 950mL,111.2 g
C. 任意规格,117gD. 500mL,111.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13;B的化合物种类繁多,数目庞大;C、D 是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:_______ ,F的原子结构示意图为_______。
(2)B、D形成的化合物 BD2中存在的化学键为_______ 键(填“离子”或“共价”,下同),A、C、F三种元素形成的化合物CA4F为_______化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为_______。
(4)A、C、D、E的原子半径由大到小的顺序是_______(用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_______于F(填“强”或“弱”),并用化学方程式证明上述结论_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+= CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu = Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列有关它的性质的叙述中,正确的是
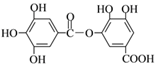
A. 有弱酸性,1 mol该有机物与溴水反应,最多能消耗4 mol Br2
B. 它能发生水解反应,水解后能生成两种产物
C. 在Ni催化下,1 mol该物质可以和7 mol H2发生加成反应
D. 在一定条件下,1 mol该物质最多能与6 mol NaOH完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液中,探究Fe2+和I-的还原性强弱。
[提出假设] 假设1:Fe2+还原性比I-强。
假设2:I-还原性比Fe2+强。
[验证假设] 选择几种装置进行实验:

(1)实验必需的装置是A→____________(按Cl2气流方向的顺序填写)。
(2)实验开始后,控制通入氯气的量,当通入少量氯气时,通过观察混合溶液颜色的变化________(填“能”或“不能”)判断反应的先后顺序。
(3)请在下表中写出实验步骤及预期现象和结论________、________、________、________、_______、________。

(4)为了实验成功,必须控制各物质的量。该小组称取1.52g FeSO4固体,同时称取1.66g KI固体,溶于水中配成混合溶液。为了验证上述假设,通入的Cl2体积最多不能超过________L(标准状况)。
[思考与交流]
(5)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序。于是提出另一方案:往KI溶液中滴入________溶液,如果能发生反应,即可证明I-的还原性强于Fe2+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不能加快锌粒与1 molL-1H2SO4反应产生H2的速率的是
A. 用锌粉代替锌粒B. 加少量醋酸钠固体
C. 加少量CuSO4固体D. 改用2 molL-1H2SO4与锌粒反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,c(Ag+)由大到小的顺序为:_________。
(2) 含有Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() 。为了使废水的排放达标,进行如下处理:Cr2O
。为了使废水的排放达标,进行如下处理:Cr2O![]()
![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH3)、Fe(OH)3
Cr(OH3)、Fe(OH)3
(a) 该废水中加入绿矾和H+,发生反应的离子方程式为__________________。
(b) 若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为_____
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。请回答下列问题:
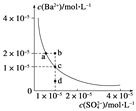
(a) 下列说法正确的是________(填序号)。
A.向BaSO4饱和溶液中加入固体Na2SO4可以由a点变到b点
B.通过蒸发可以由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(b) 将100 mL 1 mol·L-1 H2SO4溶液加入100 mL含Ba2+ 0.137 g的溶液中充分反应后,过滤,滤液中残留的Ba2+的物质的量浓度约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列有机物的判断错误的是( )
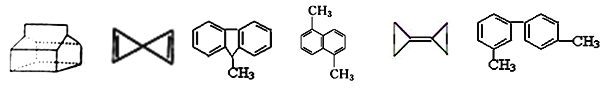
① ② ③ ④ ⑤ ⑥
A. 除①外,其它有机物均可使酸性高锰酸钾溶液褪色
B. ③④⑥都属于芳香烃。④⑥苯环上的一溴代物的同分异构体数目均有6种
C. ②⑤的一氯代物均只有一种,①的一氯代物有四种,④苯环上的二氯代物有9种,
D. ④⑤⑥的所有碳原子可能处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com