
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1 mol N2有3 mol 电子转移 | D. | 该反应不属于复分解反应 |
分析 反应3Cl2+2NH3=N2+6HCl中,Cl元素化合价降低,被还原,Cl2为氧化剂,N元素化合价升高,被氧化,NH3为还原剂,NH3可与HCl反应生成氯化铵,有白烟生成,以此解答.
解答 解:A.反应生成HCl,NH3可与HCl反应生成氯化铵,有白烟生成,故A正确;
B.Cl元素化合价降低,被还原,Cl2为氧化剂,故B正确;
C.N元素化合价由-3价升高到0价,则生成1molN2时有6mol电子转移,故C错误;
D.反应中Cl和N元素化合价发生变化,属于氧化还原反应,不属于复分解反应,故D正确.
故选C.
点评 本题考查氯气的性质,侧重于化学与生活、生产的联系以及氧化还原反应的考查,注意从元素化合价的角度解答该题,难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
已知某可逆反应在密闭容器中进行:A(g) + 2B(g) 3C(g) + D(s) △H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可能采取的措施是
3C(g) + D(s) △H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可能采取的措施是
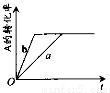
A.增大A的浓度或减少C的浓度
B.缩小容器的容积或加入催化剂
C.升高温度或增大压强
D.由a变成b,A和B的物质的量与C、D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | ||
| 1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |

| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| X | M层的电子数为K层电子数的3倍 |
| Y | 短周期中最活泼的金属元素 |
| Z | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是内层电子数的三倍 |
| C | 在第三周期中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.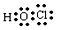 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
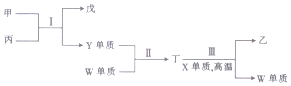
| A. | 原子半径:X<Y<Z | |
| B. | 反应Ⅰ中丙既能做氧化剂又作还原剂 | |
| C. | 非金属性:X>Y>W | |
| D. | 反应Ⅱ和Ⅲ反应均属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小 | |
| B. | 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu | |
| C. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H>0,△S<0 | |
| D. | 将如图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深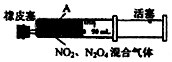 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤化氢中,以HF沸点最高,是由于HF分子间存在氢键 | |
| B. | 邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低 | |
| C. | H2O的沸点比HF的沸点高,是由于水中氢键键能大 | |
| D. | 氨气极易溶于水与氨气分子和水分子形成氢键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
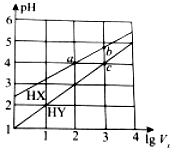 25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )
25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )| A. | HX为弱酸,HY为强酸 | B. | 当lgV0=7时,HY的pH=8 | ||
| C. | 溶液中水的电离程度:a=c<b | D. | 当lgV0=2时,c(X-)<c(Y-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com