
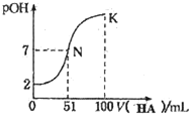
 常温下,向100mL 0.01mol•L-1 MOH溶液中逐滴加入0.02mo1•L-1 HA溶液,图中所示曲线表示混合溶液的pOH变化情况(溶液体积变化忽略不计),溶液中pOH=-lgc(OH-).下列说法中,不正确的是( )
常温下,向100mL 0.01mol•L-1 MOH溶液中逐滴加入0.02mo1•L-1 HA溶液,图中所示曲线表示混合溶液的pOH变化情况(溶液体积变化忽略不计),溶液中pOH=-lgc(OH-).下列说法中,不正确的是( )| A. | MOH为一元强碱 | |
| B. | N点水的电离程度大于K点水的电离程度 | |
| C. | 该温度下HA的电离平衡常数为5×10-6mo1•L-1 | |
| D. | 若K点对应溶液的pOH=10,则有c(HA)+c(H+)-c(OH-)=0.01mol•L-1 |
分析 0.01mol•L-1 MOH溶液中pOH=2,则MOH是强碱,N点时溶液呈中性,HA的物质的量大于MOH的物质的量,说明HA是弱酸,酸或碱性溶液抑制水电离,含有弱根离子的盐促进水电离,然后根据N点数据计算该温度下HA的电离平衡常数,最后根据K点的电荷守恒、物料守恒计算c(HA)+c(H+)-c(OH-).
解答 解:0.01mol•L-1 MOH溶液中pOH=2,则MOH是强碱,N点时溶液呈中性,HA的物质的量大于MOH的物质的量,说明HA是弱酸,
A.0.01mol•L-1 MOH溶液中pOH=2,说明MOH是强碱,故A正确;
B.N点溶液呈中性,K点溶液呈酸性,酸性溶液抑制水电离,所以N点水的电离程度大于K点水的电离程度,故B正确;
C.N点溶液的pH=7,则c(H+)=c(OH-)=10-7mol/L,根据电荷守恒可知:c(M+)=c(A-)=$\frac{0.01×0.1}{0.151}$mol/L,c(HA)=$\frac{0.02×0.051-0.01×0.1}{0.151}$mol/L=$\frac{0.01×0.002}{0.151}$mol/L,该稳定性HA的电离平衡常数K=$\frac{1{0}^{-7}×\frac{0.01×0.1}{0.151}}{\frac{0.01×0.002}{0.151}}$=5×10-6,故C正确;
D.在K点时混合溶液体积是酸溶液的物质的量是碱的2倍,根据物料守恒结合溶液体积变化知,c(HA)+c(A-)=$\frac{0.02}{2}$mol/L①,根据电荷守恒可知,c(M+)+c(H+)=c(OH-)+c(A-)②,由①+②得:c(HA)+c(M+)+c(H+)=c(OH-)+0.01,得c(HA)+c(H+)-c(OH-)=0.01-$\frac{0.01}{2}$=0.005mol•L-1,故D错误;
故选D.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,根据图象曲线变化正确判断HA为弱酸为解答关键,注意掌握电离平衡常数的概念、电荷守恒、物料守恒的含义,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | HF比H2O稳定性更强,是由于HF分子间作用力较大 | |
| B. | CC14、N2和SiO2晶体中,各原子最外层都达到8电子稳定结构 | |
| C. | Na投入到水中,有共价键的断裂与形成 | |
| D. | 离子化合物中一定含有离子键,可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | S2-的结构示意图: | ||
| C. | CaO2的电子式: | D. | 葡萄糖的结构简式:C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 人造纤维、合成纤维和光导纤维都是有机离分子化合物 | |
| C. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| D. | 可用Si2N4、Al2O3制作高温结构陶瓷制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(NO3)2 | B. | HCl | C. | MgCl2 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同 | |
| B. | 在0.1mol/L的NaOH溶液中,由水电离出的c(H+)>$\sqrt{{K}_{W}}$ | |
| C. | 将NH4Cl溶液从20℃升温至30℃,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$增大 | |
| D. | CH3COONa和盐酸两溶液混合后,呈中性的混合溶液中:c(Na+)=c(Cl-)>c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 离子方程式2Ca2++3HCO3-+3OH-═2CaCO3↓+CO32-+3H2O可以表示NH4HCO3与澄清石灰水反应 | |
| C. | 由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | n[NH4AlSO4)2]:n[Ba(OH)2]=2:5 时发生的反应为NH4+Al3++2SO42-+2Ba2++5OH-═NH3•H2O+AlO2-+2H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池反应为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,放电时负极质量减轻 | |
| B. | 电解精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | CH3COONa稀溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ 的值增大 | |
| D. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com