
甲酸甲酯水解反应方程式为:
![]()
![]()
![]()
![]()
![]()
![]() 某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
![]()
![]()
![]() 甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
![]()
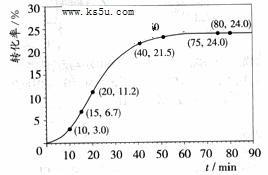
![]()
![]() (1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
![]()

![]() 请计算15~20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率
请计算15~20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率
![]() 为 mol?min-1(不要求写出计算过程)。
为 mol?min-1(不要求写出计算过程)。
![]() (2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: 。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: 。
![]() (3)上述反应的平衡常数表达式为:
(3)上述反应的平衡常数表达式为:![]() ,则该反应在温度T1下的K值为 。
,则该反应在温度T1下的K值为 。
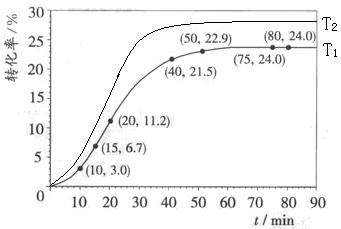
![]() (4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
![]()
![]() 【答案】(1)0.045 9.0×10-3
【答案】(1)0.045 9.0×10-3
![]() (2)该反应中甲酸具有催化作用
(2)该反应中甲酸具有催化作用
![]() ①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢。
①反应初期:虽然甲酸甲酯的量较大,但甲酸量很小,催化效果不明显,反应速率较慢。
![]() ②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大。
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大。
![]() ③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零。
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零。
![]() (3)0.14
(3)0.14
![]() (4)
(4)
![]() 【解析】(1)15min时,甲酸甲酯的转化率为6.7%,所以15min时,甲酸甲酯的物质的量为1―1.00mol×6.7%==0.933mol;20min时,甲酸甲酯的转化率为11.2%所以20min时,甲酸甲酯的物质的量为1―1.00mol×11.2%==0.888mol,所以15至20min甲酸甲酯的减少量为0.933mol―0.888mol=0.045mol,则甲酸甲酯的平均速率==0.045mol/5min==0.009mol?min-1。
【解析】(1)15min时,甲酸甲酯的转化率为6.7%,所以15min时,甲酸甲酯的物质的量为1―1.00mol×6.7%==0.933mol;20min时,甲酸甲酯的转化率为11.2%所以20min时,甲酸甲酯的物质的量为1―1.00mol×11.2%==0.888mol,所以15至20min甲酸甲酯的减少量为0.933mol―0.888mol=0.045mol,则甲酸甲酯的平均速率==0.045mol/5min==0.009mol?min-1。
![]() (2)参考答案。
(2)参考答案。
(3)由图象与表格可知,在75min时达到平衡,甲酸甲酯的转化率为24%,所以甲酸甲酯转化的物质的量为1.00×24%==0.24mol,结合方程式可计算得平衡时,甲酸甲酯物质的量==0.76mol,水的物质的量1.75mol,甲酸的物质的量==0.25mol 甲醇的物质的量==0.76mol
所以K=(0.76×0.25)/(1.75×0.76)=1/7
![]() (4)因为升高温度,反应速率增大,达到平衡所需时间减少,所以绘图时要注意T2达到平衡的时间要小于T1,又该反应是吸热反应,升高温度平衡向逆反应方向移动,甲酸甲酯的转化率减小,所以绘图时要注意T2达到平衡时的平台要低于T1。
(4)因为升高温度,反应速率增大,达到平衡所需时间减少,所以绘图时要注意T2达到平衡的时间要小于T1,又该反应是吸热反应,升高温度平衡向逆反应方向移动,甲酸甲酯的转化率减小,所以绘图时要注意T2达到平衡时的平台要低于T1。
【考点分析】考查考生对化学反应速率概念,化学平衡的了解及其影响因素的理解,对化学平衡常数简单计算的掌握,考查学生知识迁移、读图及表达能力。
![]()


科目:高中化学 来源: 题型:
 (2013?保定一模)甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l)?HCOOCH(aq)+CH3OH(aq)△H>0.某温度下,VL溶液中各组分的起始量如表:HCOOCH3转化率随反 应时间(t)的变化如图(假设溶液体积不变)下列说法正确的是( ) (2013?保定一模)甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l)?HCOOCH(aq)+CH3OH(aq)△H>0.某温度下,VL溶液中各组分的起始量如表:HCOOCH3转化率随反 应时间(t)的变化如图(假设溶液体积不变)下列说法正确的是( )
|
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省保定市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l) HCOOH(aq)+CH3OH(aq)
△H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是
HCOOH(aq)+CH3OH(aq)
△H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是

A.温度升高,该反应的平衡常数减小
B.0〜10min,HCOOCH3 的平均反应速率 u=0. 003mol·L-1 • min-1
C.HCOOCH3平均反应速率先是增大,后减小,最后保持不变
D.80min时,反应刚达平衡,反应物转化率保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com