
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: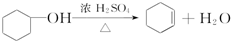
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
分析 (1)根据仪器的特征以及常见仪器的名称解答;
(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入;
(3)有活塞开关的玻璃仪器,使用前需要检查是否漏液;分液过程中,密度小的液体在上层,需从分液漏斗的上口倒出;
(4)无水氯化钙用于吸收产物中少量的水;
(5)观察题目提供的实验装置图知蒸馏过程中不可能用到吸滤瓶和球形冷凝器管;
(6)20g环己醇物质的量为0.2mol,理论上可以得到0.2mol环己烯,其质量为16.4g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)依据装置图分析可知装置a是蒸馏装置中的圆底烧瓶仪器,盛放20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,
故答案为:圆底烧瓶;
(2)碎瓷片具有疏松多孔,能引入汽化中心,碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入,
故答案为:防止暴沸;B;
(3)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出,
故答案为:检漏;上口倒出;
(4)分离提纯过程中加入无水氯化钙的目的是利用无水氯化钙吸收产物中少量的水,
故答案为:干燥;
(5)球形冷凝管可以存留部分冷凝水,不能用于组装成蒸馏装置,抽滤操作安全瓶中连接吸滤瓶,所以观察题目提供的实验装置图知蒸馏过程中不可能用到吸滤瓶和球形冷凝器管,
故答案为:CD;
(6)20g环己醇的物质的量为n=$\frac{m}{M}$=$\frac{20g}{100g/mol}$=0.2mol,理论上可以得到0.2mol环己烯,其质量为16.4g,所以产率=$\frac{实际产量}{理论产量}$×100%=$\frac{10g}{16.4g}$×100%=61%,
故答案为:61%.
点评 本题考查了物质制备实验方案设计,醇性质的分析应用,实验现象和原理的分析判断,掌握实验基本操作以及醇的性质是解题关键,题目难度中等.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.69mol/L 14.5% | B. | 8.15mol/L 15.4% | C. | 7.69mol/L 15.4% | D. | 8.17mol/L 14.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L -1AgNO3,溶液:H+、K+、SO42-、I- | |
| B. | c( H+ )/c( OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 由水电离的 c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | 甲基橙呈红色的溶液中:Na+、CO32-、Fe3+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
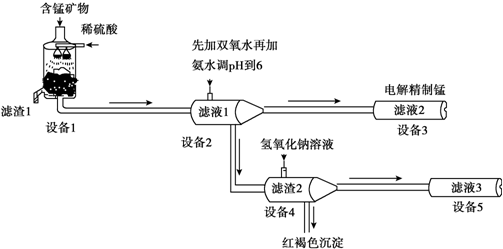
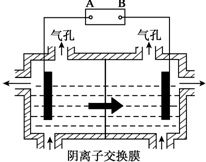 (5)设备3中用阴离子膜法提取金属锰的电解装置如图:
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/LBaCl2溶液中含有的Ba2+数为NA | |
| B. | 1mol镁离子中含有的电子数为2NA | |
| C. | 常温常压下,11.2LH2中含有H2数为0.5NA | |
| D. | 16gO3中含有氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入固体硫酸钠 | B. | 滴加几滴硫酸铜溶液 | ||
| C. | 升高稀硫酸温度 | D. | 加入硫酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.72、1.56、6.72 | B. | 4.62、5.6、3.78 | C. | 6、8、7 | D. | 6.72、6.72、1.56 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com