
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )
 A、若
A、若 为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B、若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
C、若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
D、若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应
【知识点】元素周期表与元素周期律的应用
【答案解析】B 解析:由短周期主族元素在周期表中的位置可知,X、Y处于第二周期,Z、W处于第三周期,
A、若HmXOn为强酸,则X只能为N元素,其氢化物氨气溶于水呈碱性,故A错误;B、若四种元素均为金属,则X为Li、Y为Be、Z为Na、W为Mg,Z的最高价氧化物对应的水化物为NaOH为强碱,故B正确;C、若四种元素均为非金属,则X、Z的族序数≥4,而小于7,若处于ⅣA元素,则W为P元素,对应的磷酸不是强酸,故C错误;D、若四种元素中只有一种为金属,则Z为Al、X为B、Y为C、W为Si,氢氧化铝是两性氢氧化物,溶于强酸、强碱,而硅酸属于弱酸,不能与氢氧化铝反应,故D错误。
故答案选B


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
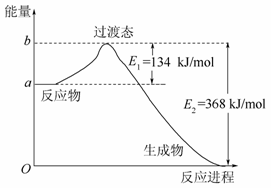
1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。

图Ⅰ
图Ⅱ
(1)图Ⅰ是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是__________(填“A”“B”或“C”);
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出了化学反应的过渡态理论:化学反应并不是简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:____________________________ _________________________________________________________;
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:
己二酸是一种重要的有机二元 酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备。反应原理:
酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备。反应原理:
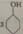 +8HNO3
+8HNO3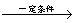 3HOOC(CH2)4COOH+8NO
3HOOC(CH2)4COOH+8NO +7H2O,反应装置(部分夹持装置和热源已省略)如图所示。
+7H2O,反应装置(部分夹持装置和热源已省略)如图所示。
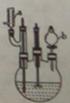
实验步骤:
I.在60mL三颈烧瓶中加入16.0mL50%硝酸(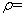 1.31g·cm-1)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b。用仪器b滴加5.3mL环己醇,搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液。
1.31g·cm-1)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b。用仪器b滴加5.3mL环己醇,搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液。
II.首先将瓶内液体加热到50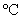 左右,开动搅拌器,滴入环己醇(
左右,开动搅拌器,滴入环己醇(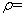 0.9624g·cm-1),使反应处于微沸状态,滴加完毕后于90
0.9624g·cm-1),使反应处于微沸状态,滴加完毕后于90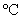 左右水浴加热20分钟,至反应完毕。
左右水浴加热20分钟,至反应完毕。
III.趁热倒出瓶中混合液于烧杯内,烧杯置于冰水浴中,静置冷却,析出产品,过滤,用少量冷水洗涤沉淀,干燥后称重。
IV.将粗产品在水中进行重结晶操作。
请回答下列问题:
(1)仪器a的名称是_________________。仪器b在使用前应_________________。
(2)偏钒酸铵的作用是_______________。
(3)反应完成后,趁热倒出反应液的目的是___ ________________
________________ 。
。
(4)本实验中己二酸的理论产量为______________g。
(5)用纯碱液吸收尾气时发生的相关化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ①
NO+NO2+Na2CO3=2NaNO2+NaNO3+CO2 ②
现用1000g质量分数为21.2%的纯碱吸收液吸收尾气,每产生22.4L(标准状况下)CO2 时,吸收液 质量就增加44g,则吸收液中NaNO2和NaNO3的物质的量之比为_________。
质量就增加44g,则吸收液中NaNO2和NaNO3的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) 2molO3与3 molO2的质量之比___________,分子数之比__________,同温同压下的密度之比________,含氧原子数之比_______________,体积之比____________________。
(2) O3与Cl2具有相似的性质,均可用于自来水的消毒。已知二者在消毒时均被还原为最低价态,则相同状况下10LO3与____________L Cl2的消毒能力相当。
(3)气体化合物A分子式可表示为OxFy,己知同温同压下l 0 mL A受热分解生成15 mLO2和10 mL F2,则A的化学式为____________推断的依据为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 ,第一电离能最小的元素是 (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
 (3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为  (保留两位有效数字)。(
(保留两位有效数字)。(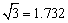 )
)
(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图
三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A + B =3C + 4D的反应中,下列表示该反应速率最大的是
A.v(A)=0.8mol / (L·min) B.v(B)=0.3mol / (L·min)
C.v(C)=0.5mol / (L·min) D.v(D)= 1mol / (L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
化学平衡状态I、II、III的相关数据如下表:
| 编号 | 化学方程式 | 平衡常数 | 温度 | |
| 979K | 1173K | |||
| I | Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
| Ⅱ | CO(g)+H2O(g) | K2 | 1.62 | b |
| Ⅲ | Fe(s)+H2O(g) | K3 | a | 1.68 |
根据以上信息判断,下列结论错误的是
A.a>b B.增大压强,平衡状态II不移动
C.升高温度平衡状态III向正反应方向移动 D.反应II、III均为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验室需要配制240 mL 0.2 mol•L-1 的Na2CO3溶液,回答下列问题:
(1)需称量Na2CO3·10H2O的质量______ g。
(2)配制时各步骤操作如下,其正确的操作顺序是(用字母表示,每个字母只能用一次)
。
A.用30 mL水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,震荡
B.用称取所需Na2CO3·10H2O 固体的质量,放烧杯中,再加入适量的水,用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的溶液沿玻璃棒注入250 mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1﹣2 cm处
(3)下列操作会使所配溶液浓度偏高的是 。
A.所选用的溶质已经变质,部分的失去了结晶水
B.转移前,容量瓶中含有少量蒸馏水
C.将未冷却的溶液沿玻璃棒注入容量瓶中
D.定容时,仰视刻度线
E.称量时误操作为“左码右物”
F.定容后使溶液混匀,静止,发现凹液面低于刻度线,立即滴蒸馏水至刻度线
(4)取所配制的碳酸钠溶液125 mL,向其加入125 mL 0.3 mol•L-1 的硫酸溶液,待充分反应后,生成的气体在标准状况下所占的体积为(假设产生的气体全部逸出)_________;设反应后溶液的体积为250 mL,则反应后溶液中Na+的物质的量浓度为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com