
| A、在100mL0.5mol/LCH3COOH溶液中CH3COOH分子数等于0.05NA |
| B、在标况下,22.4L辛烷含共价键数为25NA |
| C、已知PbI2的KSP=7.0×10-9,将1.0×10-2mol/L的KI与Pb(NO3)2溶液等体积混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为5.6×10-4 mol/L |
| D、15.6gNa2O2跟过量CO2反应时,转移电子数为2NA |
| 7.0×10-9 |
| (5.0×10-3)2 |
| 15.6g |
| 78g/mol |
| 7.0×10-9 |
| (5.0×10-3)2 |
| 15.6g |
| 78g/mol |


科目:高中化学 来源: 题型:
| A、气体甲中SO2与H2的体积比为4:1 |
| B、反应中共消耗1.8 mol H2SO4 |
| C、反应中共消耗97.5 g Zn |
| D、反应中共转移3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷 |
| B、乙醇和乙酸制乙酸乙酯;苯的硝化反应 |
| C、乙醇和氧气制乙醛;苯和氢气制环己烷 |
| D、葡萄糖与新制氢氧化铜共热;蔗糖与稀硫酸共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
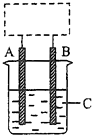 某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+2HCl=H2↑+CuCl2,请回答:
某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+2HCl=H2↑+CuCl2,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
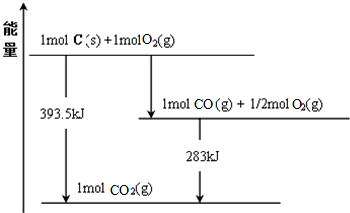
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol H2O的质量为18g/mol |
| B、OH-的摩尔质量为17g |
| C、3.01×1023个SO2分子的质量为32g |
| D、标准状况下,1 mol任何物质的体积均约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com