
【题目】下列物质中属于弱电解质的是( )
A.H2SO4
B.CaCl2
C.醋酸
D.酒精
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质组成、分类正确的是( )
A.盐酸、硫酸、硝酸都是强氧化性酸
B.新制氯水、氨水的溶质分别是次氯酸、氨分子
C.纯碱、烧碱的成分分别是碳酸钠、氢氧化钠
D.苯、聚苯乙烯、聚乙烯的组成元素以及元素质量比相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇(CH3OH)。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
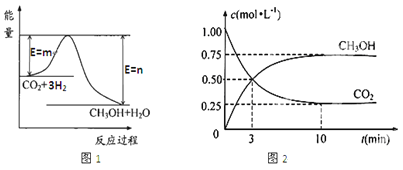
(1)该反应为_________热反应,原因是_____________________。
(2)下列能说明该反应已经达到平衡状态的是_________(填序号)
A.v (H2)=3v(CO2) B.容器内气体压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内气体密度保持不变
E.CH3OH 中1 mol H—O键断裂的同时2 mol C=O键断裂
F. 混合气体的平均摩尔质量不变
(3)在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=________。 达平衡时容器内平衡时与起始时的压强比____________。
(4)甲醇、氧气在酸性条件下可构成燃料电池,其负极的电极反应为________________,
与铅蓄电池相比,当消耗相同质量的负极物质时,甲醇燃料电池的理论放电量是铅蓄电池的___________倍(保留小数点后1位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质的方法不正确的是( )
A.铜粉中混有铁粉:加入过量盐酸充分反应,过滤
B.CO2中混有HCl:将其通入NaOH溶液,洗气
C.NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体
D.FeCl2溶液中混有少量FeC13:加入Fe粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,有关说法不正确的是( )
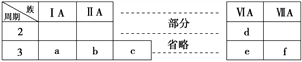
A. 元素b的单质不能与酸性氧化物发生化学反应
B. a、b、d、f四种元素的离子半径:f>d>a>b
C. 元素c的氧化物既能与酸反应又能与碱反应
D. a、c、e的最高价氧化物对应的水化物之间能够相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知煤油的密度是0.8gcm﹣3 , 试根据金属钠的保存方法和金属钠与水反应的现象推断金属钠的密度( )
A.小于0.8gcm﹣3
B.大于1.0gcm﹣3
C.介于0.8~1.0gcm﹣3
D.无法推测
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,E(g)+F(g)![]() R(g)+N(g)的平衡常数K=4/9。该温度下在A、B、C三个恒容密闭容器中,投入E(g)、F(g),其起始浓度如下表,下列判断正确的是( )
R(g)+N(g)的平衡常数K=4/9。该温度下在A、B、C三个恒容密闭容器中,投入E(g)、F(g),其起始浓度如下表,下列判断正确的是( )
起始浓度 | A | B | C |
c (E)/ molL-1 | 0.010 | 0.020 | 0.020 |
c (F)/ molL-1 | 0.010 | 0.010 | 0.020 |
A. 平衡时,B中E的转化率为大于40%
B. 平衡时,A中和C中F的转化率均为40%
C. 平衡时,C中c(R)是A中的2倍,为0.012molL-1
D. 反应开始时A和C中反应速率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com