
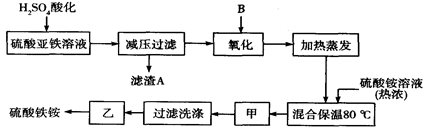
 ����һ����Һ�м���0.05 mol Ba (NO3)2��Һ��ǡ����ȫ��Ӧ�������ᱵ�����������Һ�е����������Ϊ0.05 mol ��Ҳ�������к��е�Fe2(SO4)3Ϊ0.01 mol��(NH4)2SO4Ϊ0.02 mol ����ʱ����Ϊ��0.01 mol ��400g/mol��0.02 mol ��132g/mol��6.64g��ʣ�µľ���H2O����������ôÿһ����Һ��ˮ������Ϊ��7.00g��6.64g��0.36g,n(H2O)��0.02 mol����˸�������淋Ļ�ѧʽΪ��Fe2(SO4)3��2(NH4)2SO4��2H2O
����һ����Һ�м���0.05 mol Ba (NO3)2��Һ��ǡ����ȫ��Ӧ�������ᱵ�����������Һ�е����������Ϊ0.05 mol ��Ҳ�������к��е�Fe2(SO4)3Ϊ0.01 mol��(NH4)2SO4Ϊ0.02 mol ����ʱ����Ϊ��0.01 mol ��400g/mol��0.02 mol ��132g/mol��6.64g��ʣ�µľ���H2O����������ôÿһ����Һ��ˮ������Ϊ��7.00g��6.64g��0.36g,n(H2O)��0.02 mol����˸�������淋Ļ�ѧʽΪ��Fe2(SO4)3��2(NH4)2SO4��2H2O


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ѡ�� | �� �� | �� �� | ���ͻ���� |
| A | ������Fe���м���ϡHNO3����ַ�Ӧ�μ�KSCN��Һ | ��Һ�ʺ�ɫ | ϡHNO3��Fe����ΪFe3�� |
| B | Al������ϡHNO3�� | ������ | Al�����汻ϡHNO3�������γ����ܵ�����Ĥ |
| C | ��ij��Һ�еμ�ŨNaOH��Һ�����ȣ���ʪ���ɫʯ����ֽ�����Թܿ� | ��ֽ���� | ����Һ�д���NH4�� |
| D | ����ɫʯ����Һ��ͨ��SO2 | ��Һ��ɫ | SO2��Ư���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ��� | ʵ����� | ʵ������ | ��������� |
| A | ��ij��Һ�м���BaCl2��Һ | �а�ɫ�������� | ������������ˮ��BaSO4�� ����Һ��һ������SO42�� |
| B | ������Һ�У� ���뱥��(NH4)2SO4��Һ | �а�ɫ�������� | �����ʷ��������� |
| C | ��ױ��е�������Ũ��ˮ�� ������ | ��Һ�ֲ㣬�ϲ�ʳȺ�ɫ���²㼸����ɫ | �ױ�����ˮ����ȡ����Ӧ�� ʹ��ˮ��ɫ |
| D | �������м���Ũ���� | ��ڣ����ȣ�������ͣ��ų��̼������� | Ũ���������ˮ�Ժ�ǿ�����ԣ� ��Ӧ������C��SO2��CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������25ml��ʽ�ζ�����ȡ20.00ml KMnO4��Һ |
| B���ӵ�ˮ����ȡ���ʵ⣬��������ˮ�Ҵ�����CCl4 |
| C��ʯ����ֽ��PH��ֽʹ��ǰ������ˮ��ʪ |
| D��CO2�л�������SO2�������Լ��ͷ���Ϊ��KMnO4(H+)��Ũ���ᣬϴ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
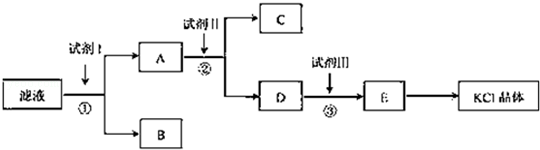
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
 NH2COONH4(s) ��H��0
NH2COONH4(s) ��H��0 
| ʵ�鲽�� | Ԥ������ͽ��� |
| ����1��ȡ����������Ʒ���Թ��У���������ˮ�������ܽ⡣ | �õ���ɫ��Һ |
| ����2�����Թ��м��������BaCl2��Һ������ | ����Һ������ǣ�֤�������в���̼��李� |
| ����3�����Թ��м������� �� | ��֤�������к���̼����李� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
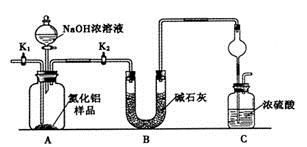
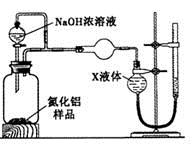

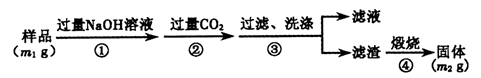
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
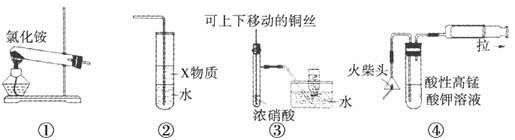
| A����װ�âٿ����Ʊ����� |
| B����װ�â���X����Ϊ����������ʵ�����Ʊ�������ˮ������ֹ�������� |
| C��װ�âۿ������Ʊ����ռ�����NO2���� |
| D��װ�âܿ��û��ͷȼ���Ʊ�����SO2�������������SO2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com