
| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu | |
| C. | SiO2$\stackrel{C/高温}{→}$Si$\stackrel{Cl_{2}/高温}{→}$SiCl4$\stackrel{H_{2}/高温}{→}$Si | |
| D. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{△}{→}$MgCl2(s)$\stackrel{电解}{→}$Mg |
分析 A.硫点燃条件下和氧气反应生成二氧化硫;
B.碱式碳酸铜和硫酸反应生成硫酸铜,硫酸铜溶液中加入钠不能置换铜,钠先和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀;
C.二氧化硅和碳在高温下反应生成硅,硅和氯气反应生成四氯化硅,四氯化硅和氢气反应生成高纯硅;
D.氢氧化镁溶于盐酸生成氯化镁溶液,氯化镁溶液加热促进水解生成氢氧化镁.
解答 解:A.硫点燃条件下和氧气反应生成二氧化硫,不能一步生成三氧化硫,需要二氧化硫催化氧化生成三氧化硫,故A错误;
B.硫酸铜溶液中加入钠不能置换铜,钠先和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,故B错误;
C.二氧化硅和碳在高温下反应生成粗硅,粗硅和氯气反应生成四氯化硅,四氯化硅和氢气反应生成高纯硅,物质间转化均能一步实现,故C正确;
D.氢氧化镁溶于盐酸生成氯化镁溶液,氯化镁溶液中氯化镁水解生成氢氧化镁和氯化氢,加热氯化氢挥发促进水解生成氢氧化镁,得不到氯化镁固体,故D错误;
故选C.
点评 本题考查了物质性质、物质反应、反应条件和产物的判断等,主要是硫、铜、硅、镁及其化合物的性质掌握,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
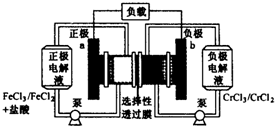 铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:Fe3++Cr2+$?_{充电}^{放电}$Fe2++Cr3+.下列说法正确的是( )
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:Fe3++Cr2+$?_{充电}^{放电}$Fe2++Cr3+.下列说法正确的是( )| A. | 电池充电时,b极的电极反应式为Cr3++e-=Cr2+ | |
| B. | 电池充电时,Cl-从a极穿过选择性透过膜移向b极 | |
| C. | 电池放电时,a极的电极反应式为Fe3++3e-=Fe | |
| D. | 电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当滴入20mL NaOH溶液时:c(SO42-)=c(NH3•H2O)+c(NH4+) | |
| B. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) | |
| C. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(SO42-) | |
| D. | 当滴入30mL NaOH溶液时,所得溶液pH>7:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氯具有强氧化性,可用于杀菌消毒 | |
| B. | 氢氧化铝具有弱碱性,可用于治疗胃酸过多 | |
| C. | 二氧化硅的熔沸点很高,可用于制作石英坩埚 | |
| D. | 钠钾合金的密度小,可用于快中子反应堆的热交换剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
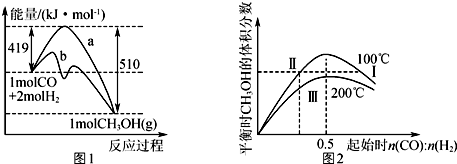
| A. | 正反应的△H=91 kJ•mol-1,曲线b表示使用了催化剂 | |
| B. | 正反应速率v正:v正(状态Ⅱ)<v正(状态Ⅲ) | |
| C. | 平衡时CO的转化率:α(CO,状态Ⅰ)<α(CO,状态Ⅱ) | |
| D. | n(CO):n(H2)=0.5时,平衡时CH3OH的物质的量浓度:c(CH3OH,1 00℃)<c(CH3OH,200℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Ca2+、Mg2+、HCO3-、Cl- | |
| B. | 使KSCN变红色的溶液中:NH4+、S2-、Br-、I- | |
| C. | c(H+)/c(OH-)=1012 的溶液中:Cu2+、Al3+、NO3-、SO42- | |
| D. | 由水电离产生的c(H+)•c(OH-)=10-8的溶液中:Na+、K+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 混合溶液/实验 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
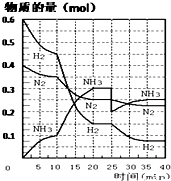
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com