
| c(标准)×V(标准) |
| V(待测) |
| ||
| 0.5L |
| W |
| 63 |
| 2 |
| 5 |
| c(标准)×V(标准) |
| V(待测) |
| 2 |
| 5 |
| ||
| V×13-3L |
| 10W |
| 63V |
| 10W |
| 63V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、检查病人胃病所用的钡餐,只能用BaSO4,不可以用BaCO3 |
| B、为了使馒头、银耳等洁白、卖相好,可以用硫黄熏蒸它们 |
| C、可以用SO2来漂白纸浆、毛、丝、草帽辫等 |
| D、氯气溶于水生成次氯酸可以用于自来水的消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:

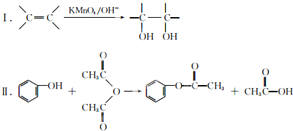
查看答案和解析>>
科目:高中化学 来源: 题型:
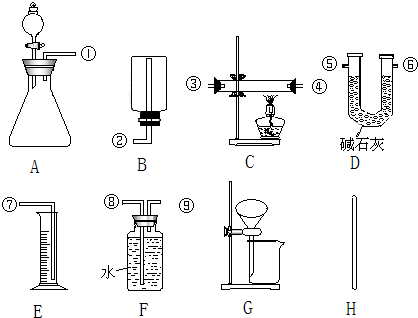
查看答案和解析>>
科目:高中化学 来源: 题型:
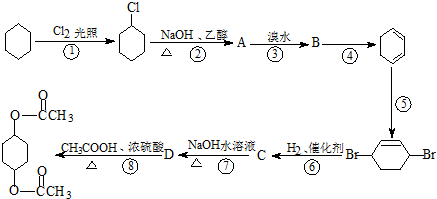
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定前滴定管中无气泡,滴定后产生气泡 |
| B、碱式滴定管量取NaOH溶液时,未进行润洗操作 |
| C、滴定时达到滴定终点时仰视读数 |
| D、锥形瓶盛装NaOH待测液前加少量水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
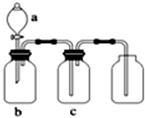 如图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( )
如图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( ) | 选项 | 气体 | a | b | c |
| A | 二氧化氮 | 浓硝酸 | 铜片 | 氢氧化钠溶液 |
| B | 二氧化硫 | 浓硫酸 | 铜片 | 酸性高锰酸钾溶液 |
| C | 氨 | 浓氨水 | 生石灰 | 碱石灰 |
| D | 二氧化碳 | 稀盐酸 | 碳酸钙 | 浓硫酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com