
| A. | Mg在CO2中燃烧生成MgO和C,是放热反应 | |
| B. | 工业上通过电解MgCl2溶液制取金属镁 | |
| C. | Mg和稀硫酸反应时,滴加少量硫酸铜溶液,能加快反应速率 | |
| D. | 镁可以用来制造信号弹和焰火,MgO可以作耐高温材料 |
分析 A.Mg在CO2中燃烧发生置换反应,生成MgO和C,所有的燃烧反应都是放热反应;
B.电解MgCl2溶液阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气,得不到金属镁;
C.滴加少量CuSO4溶液,Mg置换出Cu,构成Mg、Cu原电池,从而加快了生成氢气的反应速率;
D.镁燃烧发出耀眼的白光且放出大量热,MgO熔点高.
解答 解:A.Mg在CO2中燃烧:CO2+2Mg$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,该反应为燃烧反应属于放热反应,故A正确;
B.工业上用电解氯化镁的方法生产金属镁,MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,不是电解氯化镁溶液,故B错误;
C.Mg和稀硫酸反应时,滴加少量硫酸铜溶液,镁置换出铜,镁-铜-稀硫酸形成原电池,发生原电池反应使反应速率加快,故C正确;
D.镁燃烧时发生耀眼的白光,并放出大量的热,可用于制造信号弹,MgO熔点高,可以作耐高温材料,故D正确;
故选B.
点评 本题考查有关金属镁的知识,明确物质性质是解本题关键,注意电化学知识在该题中的应用,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 如果反应开始时加入2molN2和6molH2,则达到平衡时,n(N2):n(H2)=1:3 | |
| C. | 达到化学反应限度时,生成2mol NH3 | |
| D. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,B与A同周期,其s能级电子数比p能级电子数多,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数为29.回答下列问题:
A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,B与A同周期,其s能级电子数比p能级电子数多,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数为29.回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
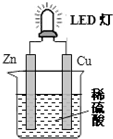
| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 如果将硫酸换成橙汁,导线中不会有电子流动 | |
| D. | 装置中存在“化学能→电能→光能”的转换 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
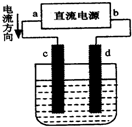
| A. | d为负极、c为正极 | B. | c电极上发生还原反应有气体产生 | ||
| C. | 电解过程中,氯离子向d电极移动 | D. | 电解过程中,d电极质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上炼铁时,常用石灰石除去铁矿石中的SiO2 | |
| B. | 工业上用接触法制硫酸,在接触室里制出硫酸 | |
| C. | 工业上用二氧化硅在高温下与焦炭反应制得高纯度的硅 | |
| D. | 工业上主要从海水中提取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
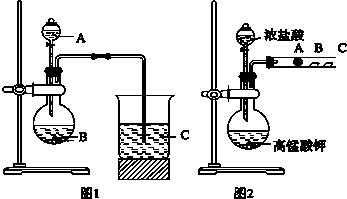
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
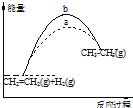
| A. | 图1的曲线说明该反应是放热反应,即CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0 | |
| B. | 化合反应都是放热反应,分解反应都是吸热反应 | |
| C. | 若图1表示有无使用催化剂时的反应进程,则b曲线使用,a曲线没使用 | |
| D. | 图中,若△H=QkJ•mol-1(Q>0),表示正反应活化能比逆反应活化能大QkJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com