
【题目】A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。
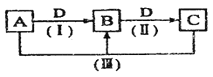
请回答下列问题。
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,写出反应(Ⅲ)的化学方程式:__________________________________(此反应的条件答题时不必写出)。B在工业上用于制备A,反应的化学方程式为:__________________________________。
(2)若B为非金属单质,且B 所含元素的原子最外层电子数与内层电子数之和的比值为3: 5,则反应(Ⅲ)的化学方程式______________________________________________,其中氧化产物与还原产物的物质的量之比为______________。
(3)若A、B、C 的溶液均显碱性,C 为焙制糕点的发酵粉的主要成分之一。
①D的电子式为________________。
②写出反应(Ⅲ)的离子方程式:________________________________________________。
③取100mL B、C的混合溶液,其中B、C浓度均为0.1mol/L ,向溶液中缓慢滴加0.1mol/L盐酸至过量,收集并测量产生气体的体积。刚开始滴加盐酸时,反应的离子方程式为___________________________。请将产生气体的体积(标准状况下且不考虑产生气体在水中的溶解)随滴加盐酸的体积变化的曲线绘制在下图坐标系中。__________
【答案】4NH3+6NO=5N2+6H2ON2+3H2![]() 2NH32H2S+SO2=3S+2H2O2:1
2NH32H2S+SO2=3S+2H2O2:1![]() OH-+HCO3-=H2O+CO32- H++CO32-=HCO3-
OH-+HCO3-=H2O+CO32- H++CO32-=HCO3-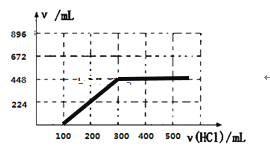
【解析】
(1)B和D为空气的主要成分,即为N2和O2,根据转化关系,A应是连续被氧化,D应为O2,B为N2,则C为NO,A为NH3,反应III的方程式为4NH3+6NO=5N2+6H2O;N2制备NH3,工业方法是合成氨,即反应方程式为N2+3H2![]() 2NH3;
2NH3;
(2)B为非金属单质,且B所含元素的原子最外层电子数与内层电子数之和的比值为3:5,推出B为S,根据转化关系,A为H2S,C为SO2,反应III的方程式为2H2S+SO2=3S+2H2O,H2S为还原剂,SO2为氧化剂,S既是氧化产物又是还原产物,因此氧化产物与还原产物的物质的量之比为2:1;
(3)C为焙制糕点的发酵粉的主要成分,即C为NaHCO3,A、B、C均含有同一种元素,三种物质均显碱性,根据转化关系,推出A为NaOH,B为Na2CO3,D为CO2,①CO2的电子式为![]() ;
;
②反应III的离子方程式为HCO3-+OH-=H2O+CO32-;
③B和C混合构成的溶液为Na2CO3和NaHCO3,向混合液中滴加盐酸,发生H++CO32-=HCO3-,消耗的是盐酸的体积为100mL,此时溶液中NaHCO3的物质的量为(100×10-3×0.1+100×10-3×0.1)mol=0.02mol,继续滴加盐酸发生HCO3-+H+=CO2↑+H2O,此时消耗盐酸的体积200mL,产生CO2的体积为0.02×22.4L=0.448L,即为448mL,图像为:
 。
。


科目:高中化学 来源: 题型:
【题目】把A、B、C、D四块金属片浸入稀硫酸中,分别用导线两两相连可以组成原电池。A、B相连时A为负极;C、D相连时,电流由D→C;A、C相连时,C极上产生大量气泡,B、D相连时,D极发生氧化反应。这四种金属的活动性顺序是
A.A>B>C>DB.A>C>D>BC.C>A>B>DD.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“长征二号”系列火箭用的燃料是液态的偏二甲肼(C2H8N2),氧化剂是液态的N2O4,已知已知1.5g偏二甲基肼完全燃烧生成N2、CO2和液态H2O放出热量50kJ热量。下列说法不正确的是
A. 燃料在火箭发动机中燃烧是将化学能主要转变为热能和机械能
B. 液态N2O4气化时共价键没被破坏
C. 依题可知C2H8N2的燃烧热为50kJ/mol
D. 偏二甲基肼在N2O4中燃烧时的化学方程式为:C2H8N2+2N2O4![]() 2CO2+3N2+4H2O
2CO2+3N2+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如下装置![]() 略去部分夹持仪器
略去部分夹持仪器![]() 制取
制取![]() 并验证其性质.
并验证其性质.
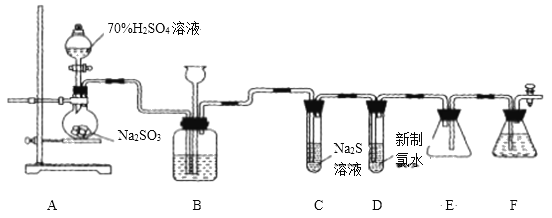
(1)盛装![]() 的仪器名称为__________
的仪器名称为__________ ![]() ,还缺少的玻璃仪器是________,用
,还缺少的玻璃仪器是________,用![]() 的化学方程式_______.
的化学方程式_______.
(2)装置B的作用之一是通过观察产生气泡的多少判断![]() 生成的快慢,其中的液体最好选择____
生成的快慢,其中的液体最好选择____![]() 填代号
填代号![]() .
.
a. 饱和![]() 溶液 b. 饱和
溶液 b. 饱和![]() 溶液
溶液
c. 饱和![]() 溶液 d. 饱和NaHSO3溶液
溶液 d. 饱和NaHSO3溶液
(3)验证二氧化硫的氧化性的装置是______,现象为_______________.
(4)为验证二氧化硫的还原性,充分反应后,取该试管中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入![]() 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入![]() 溶液,产生白色沉淀.
溶液,产生白色沉淀.
上述方案合理的是方案________![]() 填“I”、“Ⅱ”或“Ⅲ”
填“I”、“Ⅱ”或“Ⅲ”![]() ;若将试管D中新制氯水改为酸性高锰酸钾溶液,则发生反应的离子方程式为____________________.
;若将试管D中新制氯水改为酸性高锰酸钾溶液,则发生反应的离子方程式为____________________.
(5)装置F的作用是___________________![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事故的处理方式不恰当的是
A. 实验时手不慎被玻璃划伤,先取出伤口中的碎玻璃片再用双氧水清洗,然后敷药包扎
B. 酒精灯着火了用湿毛巾盖灭
C. 将CO中毒者移至通风处抢救
D. 不慎将NaOH溶液粘在皮肤上,先用大量水冲洗,再涂上盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)===CO2(g)+3H2(g)。下图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)===CO2(g)+3H2(g)的ΔH________0(选填“>”“=”或“<”)。
②图中途径(Ⅱ)的条件是__________________,途径(Ⅰ)的反应热________途径(Ⅱ)的反应热(选填“>”“=”或“<”)。
③在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为__________________________________________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去)。

(1)配制氯化铁溶液时,需先把氯化铁晶体溶解在______中,再加水稀释,这样操作的目的是__________________________________________。
(2)通入足量SO2时,装置C中观察到的现象为___________________________________。
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式____________________________________;
②请设计实验方案检验有Fe2+ 生成___________________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42 -,该做法____(填“合理”或“不合理”),理由是__________。
(4)D装置中倒置漏斗的作用是_________________________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有____________(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com