
����Ŀ��X��Y��Z��M��Q��R��6�ֶ�����Ԫ�أ���ԭ�Ӱ뾶����Ҫ���ϼ����£�
Ԫ�ش��� | X | Y | Z | M | Q | R |
ԭ�Ӱ뾶/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
��Ҫ���ϼ� | ��2 | ��3 | ��6����2 | ��5����3 | ��4����4 | ��1 |
��1��Z��Ԫ�����ڱ��е�λ����_________________________��
��2��Ԫ��Q��R�γɵĻ�����A�ǹ�ʵ���������A�Ʊ��Ҵ��Ļ�ѧ����ʽ��_______________________��
��3������ͭ��Ԫ��M������������Ӧˮ�����Ũ��Һ������Ӧ�����ӷ���ʽΪ___________________��
��4��Ԫ��X�Ľ����Ա�Ԫ��Y______���ǿ������������
��5��Ԫ��Q��Ԫ��Z�ĺ���Ӱ��������ܣ�������ͼװ��A�ڸ����½�������Ԫ��Q��Ԫ��Zת��ΪQO2��ZO2��

������a�ijɷ���________________���ѧʽ����
����������Ԫ��Z��FeZ����ʽ���ڣ���A�з�Ӧ����ZO2���ȶ��ĺ�ɫ�������Ӧ�Ļ�ѧ����ʽ��_________________________________��
���𰸡��������ڵڢ�A�� CH2=CH2+H2O![]() CH3CH2OH Cu+4H++2NO3-��Cu2++2NO2��+2H2O ǿ O2��SO2��CO2 5O2+3FeS
CH3CH2OH Cu+4H++2NO3-��Cu2++2NO2��+2H2O ǿ O2��SO2��CO2 5O2+3FeS![]() 3SO2+Fe3O4
3SO2+Fe3O4
��������
����Z�Ļ��ϼۣ�6����2���������Ķ�����Ԫ��ֻ��S��������ͬ���ڣ�������ԭ�Ӱ뾶���μ�С��S��ԭ�Ӱ뾶Ϊ0.102���ӱ������ݣ�X�Ļ��ϼ�Ϊ+2��Y�Ļ��ϼ�Ϊ+3����ԭ�Ӱ뾶��S��X��Yֻ��Ϊ�����ڣ�XΪMg��YΪAl����MΪ��5�ۣ�QΪ+4�ۣ�����ԭ�Ӱ뾶��SС������ֻ���Ƕ����ڣ�MΪN��QΪC��R��ԭ�Ӱ뾶��M��Q��С����������Li��ֻ����H��
(1)���ݷ�����ZΪ��Ԫ�����ڱ��е�λ���ǵ������ڵڢ�A�壬�ʴ�Ϊ���������ڵڢ�A�壻
(2) A�ǹ�ʵ�������Ϊ��ϩ������ϩ�Ʊ��Ҵ��Ļ�ѧ����ʽCH2=CH2+H2O![]() CH3CH2OH���ʴ�Ϊ��CH2=CH2+H2O
CH3CH2OH���ʴ�Ϊ��CH2=CH2+H2O![]() CH3CH2OH��
CH3CH2OH��
(3) M������������Ӧˮ����ΪHNO3��ͭ��Ũ���ᷴӦ�����ӷ���ʽΪCu+4H++2NO3-��Cu2++2NO2��+2H2O���ʴ�Ϊ��Cu+4H++2NO3-��Cu2++2NO2��+2H2O��
(4)XΪMg��YΪAl��ͬ���ڣ������ҽ��������μ�����Mg�Ľ�����ǿ���ʴ�Ϊ��ǿ��
(5) ��Ԫ��QΪC��Ԫ��ZΪS���������⣬����a����SO2��CO2���Լ�δ��Ӧ���O2���ʴ�Ϊ��O2��SO2��CO2��
�ڸ������⣬FeS��A��������SO2�ͺ�ɫ���壬����ɫ������һ����Fe������ΪFe3O4����Ӧ�Ļ�ѧ��Ӧ����ʽΪ��5O2+3FeS![]() 3SO2+Fe3O4��
3SO2+Fe3O4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��ͬ����ǽ���Ԫ�����ʵĵݱ���ɣ�ij�о���ѧϰС��ļ�ͬѧ�������ͼ��ʾ��ʵ��װ�ã�����Aװ���ڿ�����Cl2��

(1)��ͬѧ�IJ���ʵ���¼���£�B���������ɫ��C������ɳȺ�ɫ����ͬѧ�ɴ�����ó��Ľ�����ͬ������ϵ���Ԫ�صķǽ����Լ�����
��B��������Ӧ�Ļ�ѧ����ʽΪ_________��
�ڼ�ͬѧ�Ľ�����________(������ȷ����������ȷ��)�ģ�������____________________��
(2)��ͬѧ��ΪӦ����ͬѧʵ����B��C������������λ�ã����������û����壬Ȼ��������KI�Ӵ������ж�Br2��KI�ܷ�����Ӧ����������________(����������������������)�ģ�ԭ����___
(3)��ͬѧ�ڼ�ͬѧ��ʵ�������ȡ��C����������������һ��մ�е���KI��Һ����(E)�Ӵ�������E����������ɫ����ϼ�ʵ����������Ϊ����ȷ��ͬ����Ԫ�طǽ����Եĵݱ���ɣ���ͬ����ֹ۵���______(����ͬ����������ͬ����)��������__________
(4)��ͬѧ�ۺϷ�����ǰ�漸λͬѧ��ʵ�飬��Ϊ����մ��Na2S��Һ�������ڲ��������ʵ���λ�ã���ʵ�黹����ͬʱ̽��ͬ����Ԫ�����ʵĵݱ���ɣ�������˹۵��������___��Ԥ�ڵ������������___________����Ӧ��Ӧ�����ӷ���ʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����������Ϊ��Ӧ���ɻ�ԭ����֤��֮һ���ǣ������ӵ����ɣ���ͬ��ͬѹ�£���ͬ������κ����庬����ͬ��Ŀ�ķ��ӣ�

A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ����Ҫ�Ļ���ԭ�ϣ��㷺Ӧ���ڻ���������Ҳ����ֱ������ȼ�ϣ���֪��
CH3OH��l��+O2��g��=CO��g��+2H2O��g�� ��H1=��443.64kJmol��1
2CO��g��+O2��g��=2CO2��g�� ��H2=��566.0kJmol��1
����˵�����Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A.CO��ȼ����Ϊ566.0kJmol��1
B.2molCO��1molO2����������2molCO2����������
C.��ȫȼ��20g�״������ɶ�����̼��ˮ����ʱ�ų�������Ϊ908.3kJ
D.2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=��1453.28kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ͽ�1 mol Cl2(g)��Cl��Cl����Ҫ����243 kJ���������������仯ʾ��ͼ������˵�����Ȼ�ѧ����ʽ��ȷ����
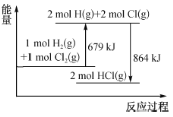
A.H2(g)+Cl2(g)=2HCl(g) ��H=��185 kJ��mol��1
B.����1 mol H2(g)�е�H��H���ų�121.5 kJ����
C.�Ͽ�1 mol HCl(g)�е�H��Cl��Ҫ����864 kJ����
D.HCl(g)=![]() H2(g)+
H2(g)+![]() Cl2(g) ��H=��92.5 kJ��mol��1
Cl2(g) ��H=��92.5 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����ڱ��ж����ڵ�һ���֣�����˵����ȷ����
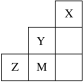
A.�縺�ԣ�Y��Z��M
B.���Ӱ뾶��M����Z2����Y��
C.Z��M����ۺ������з��ǻ���ԭ�����ֱ�Ϊ2��3
D.ZԪ�ػ�̬ԭ�ӵĹ����ʾʽΪ��![]()
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Ga)����ͬ���壬������Ϊ����������������������������Ϊ���Ի������ҵ�Ʊ��ص���������ͼ��ʾ��

�����жϲ��������ǣ�
A. Al��Ga������IIIA��
B. Ga2O3�������ᷴӦ����GaCl3
C. Ga(OH)3����NaOH��Ӧ����NaGaO2
D. ���ԣ�Al(OH)3>Ga(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������ij��ͬ���칹��ֻ��һ��һ�ȴ������д���Ľṹ��ʽ_______
��2��ijȲ����������ּӳ�����2��5���������飬��Ȳ���Ľṹ��ʽ��_______
��3��ij�������ṹΪ![]() ����һ�ȴ�����_______�֡�
����һ�ȴ�����_______�֡�
��4������ʽΪC6H12��ij��������̼ԭ�Ӷ���ͬһƽ���ϣ�������Ľṹ��ʽΪ_______��������ʽΪC4H6��ij�������е�̼ԭ�Ӷ���ͬһ��ֱ���ϣ�������Ľṹ��ʽΪ_______��
��5�� ����ʽΪC8H10�ķ������������ϵ�һ�ȴ���ֻ��һ�֣��÷������Ľṹ��ʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 mol A(g)��2 mol B(g)��2 L�ĺ����ܱ������л�ϲ���һ�������·�����Ӧ��2A(g)+B(g) 2C(g)����H<0����Ӧ2 s����C��Ũ��Ϊ0.6 mol��L-1������˵����ȷ����
A.2 s������A��ת����Ϊ70%
B.��������Ũ������c(A)=2c(B)=c(C)ʱ���÷�Ӧ�ﵽ��ƽ��״̬
C.�ﵽƽ��״̬ʱ������A�����ʵ�����A��B��ת���ʶ����
D.�ﵽƽ��״̬ʱ�������¶ȣ�ƽ�������ƶ���ͬʱ��ѧƽ�ⳣ��K��С
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com