
分析 (1)根据各能级含有的轨道分析,s能级只有1个轨道,p能级有3个轨道,d能级有5个轨道,f能级有7个轨道,注意不存在2d、3f能级,结合选项符号能否指明确定的轨道进行判断;
(2)根据第一电离能递变规律判断,同主族元素从上到下第一电离能逐渐减小;
(3)Se是34号,M层已排满;
(4)Mn原子核外电子数为25,处于第四周期ⅦB族,基态电子排布式为:1s22s22p63s23p63d54s2;
(5)Ni的外围电子排布为3d84s2,3d能级上有2个未成对电子.
解答 解:(1)A.2s能级只有1个轨道,故2s可以表示原子轨道,故A正确;
B.不存在2d能级,故B错误;
C.3p能级含有3个轨道,3个轨道相互垂直,3px表示为x轴上的轨道,故C正确;
D.不存在3f能级,故D错误;
故答案为:AC;
(2)同主族元素从上到下,原子半径越来越大,原子核对核外电子的吸引力越来越弱,第一电离能逐渐减小,故答案为:O>S>Se;
(3)Se是34号,核外电子排布式为1s22s22p63s23p63d104s24p4,则第三层M层的电子排布式为3s23p63d10,故答案为:3s23p63d10;
(4)Mn原子核外电子数为25,处于第四周期ⅦB族,基态电子排布式为:1s22s22p63s23p63d54s2,所以Mn2+基态的核外电子排布式为:1s22s22p63s23p63d5或[Ar]3d5,故答案为:1s22s22p63s23p63d5或[Ar]3d5;
(5)Ni的外围电子排布为3d84s2,3d能级上有2个未成对电子,第二周期中未成对电子数为2的元素有C、O,其中C的电负性小,故答案为:C.
点评 本题考查核外电子排布,比较基础,注意第一电离能、电负性的变化规律,熟悉核外电子排布规律是解题的关键,难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:多选题
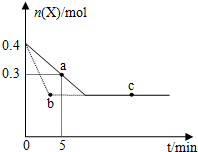
| A. | 虚线表示使用催化剂的情形 | |
| B. | b、c两点表明反应在相应条件下达到了最大限度 | |
| C. | 反应进行到a点时放出的热量大于反应进行到b点时放出的热量 | |
| D. | 反应从开始到a点的平均反应速率可表示为v(Y)=0.01mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
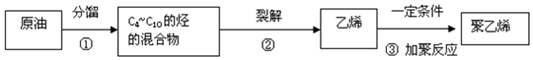
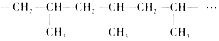 其重复结构单元即它的链节是
其重复结构单元即它的链节是 .
.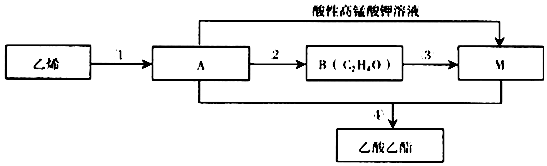
 ,由A生成B的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
,由A生成B的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O. CH3COOCH2CH3+H2O,除去乙酸乙酯中混有A和M的方法通入饱和碳酸钠溶液吸收.
CH3COOCH2CH3+H2O,除去乙酸乙酯中混有A和M的方法通入饱和碳酸钠溶液吸收.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| B. | 远洋海轮的尾部装上一定数量的锌板 | |
| C. | 用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 | |
| D. | 常温条件下,在空气中铝不易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、OH-、Na+、CO32- | B. | Cl-、Na+、Ag+、NO3- | ||
| C. | Fe3+、Cl-、Na+、OH- | D. | NH4+、Cl-、Na+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3s2表示3s能级有两个轨道 | |
| B. | 处于最低能量的原子叫做基态原子 | |
| C. | 同一原子中,1s、2s、3s电子的能量逐渐减小 | |
| D. | 同一原子中,3d、4d、5d能级的轨道数依次增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
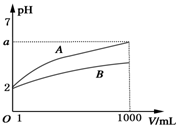 pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )
pH=2的A、B两种酸溶液各取1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是( )| A. | 稀释后A溶液的酸性比B溶液弱 | |
| B. | a=5时,A是强酸,B是弱酸 | |
| C. | 若A、B都是弱酸,则5>a>2 | |
| D. | A、B两种酸溶液物质的量浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
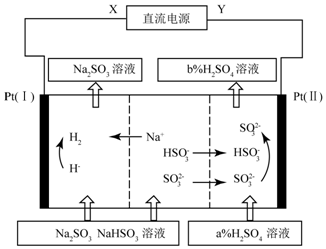
| A. | X为直流电源的正极,Y为直流电流的负极 | |
| B. | 图中的b<a | |
| C. | P(I)附近溶液的pH减小,Pt(II)附近溶液的pH增大 | |
| D. | 再生机理为:Pt(I)H+放电,导致“HSO3-?SO2-+H+”平衡右移 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
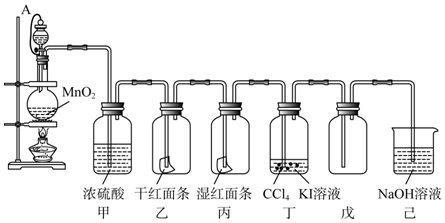
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com