
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| C. | 含4.8g碳元素的石墨晶体中的共价键数为1.2NA个 | |
| D. | 2mL 0.5mol/L硅酸钠溶液中滴入过量盐酸制备硅酸胶体,所得胶粒数目为0.001NA |
分析 A.二氧化硫和氧气反应生成三氧化硫的反应是可逆反应,不能进行彻底;
B.标准状况下二氯甲烷不是气体;
C.在石墨晶体中,每个碳原子参与形成三条共价键,利用均摊法来计算;
D.胶体微粒是硅酸的集合体;
解答 解:A.二氧化硫和氧气反应生成三氧化硫的反应是可逆反应,一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA ,故A正确;
B.标准状况下二氯甲烷不是气体,22.4L二氯甲烷的物质的量不是1mol,故B错误;
C.石墨中每个碳原子参与形成三条共价键,即每个碳原子形成的共价键的个数=3×$\frac{1}{2}$=1.5,含4.8g碳元素的石墨晶体中,含有碳原子是0.4mol,共价键是0.4mol×1.5=0.6mol,故C错误;
D.2mL 0.5mol/L硅酸钠溶液中滴入过量盐酸制备硅酸胶体,所得胶粒数目小于0.001NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是微粒结构、气体摩尔体积条件应用、胶体微粒的组成等知识点,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:实验题
某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2,其部分生产流程如下:
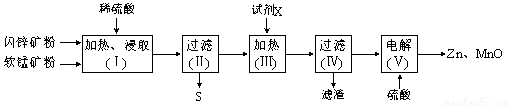
已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(1)加热、浸取时所加矿石均需粉碎,其目的是 。
(2)写出FeS和MnO2和稀硫酸反应的离子方程式: 。
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3。pH调节的范围是 ,试剂X可以选用 (填选项字母)。
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3·H2O
(4)电解(Ⅴ)中阳极的电极反应式为 。
(5)Zn和MnO2是制作电池的原料。某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。该电池的正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
 ;
;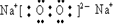 .
. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无机非金属材料中不可能含有金属元素 | |
| B. | 铝盐、铁盐有净水作用,向浑浊的水中加入少量明矾或硫酸铁溶液,搅拌,过一段时间,水的底部会出现很多絮状不溶物,水变澄清透明 | |
| C. | 氯化物在化学工业领域有重要应用,例如SiCl4、GeCl4、TiCl4分别是制取高纯硅、锗和钛的重要中间物质 | |
| D. | 地球上存在的天然二氧化硅形态有结晶形和无定形两大类统称硅石 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | NH4HSO3受热分解产生的气体全部通入Ba(NO3)2溶液中 | 产生白色沉淀 | 沉淀为BaSO4 |
| B | 浓度均为0.1mol•L-1Zn2+和Cu2+混合溶液中滴入少量Na2S溶液 | 产生黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| C | 2mLpH=3的盐酸和2mLpH=3醋酸,同时分别加入足量相同的锌粉 | 反应速率不同 | 较快的为盐酸 |
| D | 待测液X中加入KSCN溶液无明显现象,加入H2O2酸性溶液 | 溶液变为红色 | X中含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
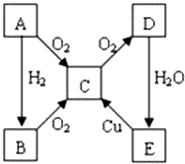 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.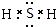 ;
; CO2↑+2SO2↑+2H2O.
CO2↑+2SO2↑+2H2O.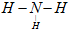 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com