
氢气还原氧化铜:CuO+H2 Cu+H2O,该反应中( )
Cu+H2O,该反应中( )
|
| A. | CuO作还原剂 | B. | CuO作氧化剂 |
|
| C. | 铜元素化合价降低 | D. | 氢气发生氧化反应 |
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
若图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池,则下列的说法中正确的是( )
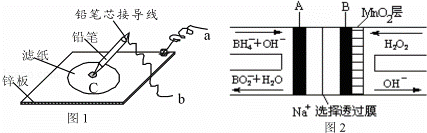
|
| A. | 图2电池在放电过程中,正极区的电极反应为:BH4﹣﹣8e﹣+8OH﹣═BO2﹣+6H2O |
|
| B. | 若用稀硫酸浸湿滤纸并用导线将a、b相连,则有电子从b极流出通过导线流向a极 |
|
| C. | 若用硫酸钠和紫色石蕊的混合溶液浸湿滤纸并用导线将a、b相连,则可看到铅笔芯C点处浸有紫色石蕊的滤纸变蓝,此处发生电极反应为:O2+2H2O+4e﹣═4OH﹣ |
|
| D. | 若用KI﹣淀粉溶液浸湿滤纸,同时用导线将a、b分别与A、B电极相连,若看到铅笔芯C点处出现变蓝现象,则b极连接的是燃料电池的A极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的用途的叙述正确的是( )
|
| A. | 可用铝制容器盛装稀硫酸 |
|
| B. | Na2O2可用于呼吸面具中作为氧气的来源 |
|
| C. | FeO常用于制造红色油漆和涂料 |
|
| D. | SiO2可用于制造太阳能电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案设计中,可行的是( )
|
| A. | 用金属钠检验酒精中是否含有水 |
|
| B. | 用AgNO3溶液检验Na2CO3溶液中混有的NaCl杂质 |
|
| C. | 用萃取的方法分离汽油和煤油 |
|
| D. | 用焰色反应区分NaCl和CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
随着建筑装饰材料进入百姓家庭,某些装饰不久的居室由于装饰材料释放出来的有机污染物浓度过高,影响人体健康.这些污染物最常见的是( )
|
| A. | 一氧化碳 | B. | 甲醛 | C. | 臭氧 | D. | 苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
正丁烷和异丁烷互为同分异构体,下列关于它们的说法正确的是( )
|
| A. | 具有相似的化学性质 |
|
| B. | 具有相同的物理性质 |
|
| C. | 是不同的物质 |
|
| D. | 分子式相同,但分子内碳原子的连接方式不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 单体的质量之和就是所生成高聚物的质量 |
|
| B. | 单体是一种物质时发生加聚反应 |
|
| C. | 缩聚反应的单体只有一种 |
|
| D. | 淀粉和纤维素因聚合度不同所以他们不是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
酚醛树脂可用苯酚和甲醛反应制得.实验室制备酚醛树脂时,在酸性条件下,苯酚过量制得酚醛树脂若不易取出,则可趁热时加入一些乙醇来取出酚醛树脂;在碱性条件下,苯酚过量时,若酚醛树脂不易取出时,用加热或加溶剂的方法都很难将酚醛树脂取出.在上述两种情况下,下列有关叙述正确的是( )
|
| A. | 酸性条件制得的是体型结构酚醛树脂,碱性条件制得的是线型结构酚醛树脂 |
|
| B. | 酸性条件制得的是线型结构酚醛树脂,碱性条件制得的是网状结构酚醛树脂 |
|
| C. | 两种条件下制得的都是线型结构的酚醛树脂 |
|
| D. | 两种条件下制得的都是网状结构酚醛树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 mol•L-1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是
(结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或 “不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
 |
实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH—
H2S2O3+2OH—
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40 mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O) 。试回答:
① 此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
② 若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果 (填“偏高”“偏低”或“不变”)。
③ 产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com