
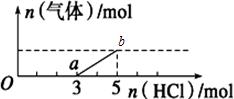
| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | 标准状况下,通入CO2的体积为4.48L | |
| C. | ab段反应的离子方程式为:HCO${\;}_{3}^{-}$+H+=CO2↑+H2O | |
| D. | 原NaOH溶液的物质的量浓度为2.5mol•L-1 |
分析 A.Na2CO3跟盐酸的反应是分步进行的:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,由图象可知生成二氧化碳消耗的HCl的物质的量小于从反应到开始产生二氧化碳阶段消耗的HCl,故溶液中溶质为NaOH、Na2CO3;
B.由图可知,a点时开始生成气体,故发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,至生成二氧化碳体积最大时,该阶段消耗的HCl的物质的量为2mol,据此根据方程式计算生成的二氧化碳的物质的量,生成的二氧化碳的物质的量等于开始通入的二氧化碳的物质的量,根据V=nVm计算二氧化碳的体积;
C.ab段开始生成二氧化碳气体,说明发生反应为碳酸氢根离子与氢离子反应生成二氧化碳气体和水;
D.生成二氧化碳体积最大时,此时溶液中溶质为NaCl,根据氯离子守恒有n(NaCl)=n(HCl),再根据钠离子守恒有n(NaOH)=n(NaCl),根据c=$\frac{n}{V}$计算NaOH溶液的物质的量浓度.
解答 解:A.Na2CO3跟盐酸的反应是分步进行的:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,HCl与Na2CO3、NaHCO3都按1:1反应,由图象可知生成二氧化碳消耗的HCl的物质的量小于从反应到开始产生二氧化碳阶段消耗的HCl,故溶液中溶质为NaOH、Na2CO3,故A正确;
B.由图可知,a点时开始生成气体,故发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,至生成二氧化碳体积最大时,该阶段消耗的HCl的物质的量为2mol,由方程式可知产生二氧化碳的物质的量为2mol,生成的二氧化碳的物质的量等于开始通入的二氧化碳的物质的量,故开始通入的二氧化碳的体积为2mol×22.4L/mol=44.8L,故B错误;
C.ab段开始生成二氧化碳气体,之至二氧化碳的物质的量达到最大,说明反应的离子方程式为:HCO3-+H+=CO2↑+H2O,故C正确;
D.加入5molHCl生成二氧化碳体积最大,此时溶液中溶质为NaCl,根据氯离子守恒有n(NaCl)=n(HCl),根据钠离子守恒有n(NaOH)=n(NaCl),故n(NaOH)=n(HCl)=5mL,所以c(NaOH)=$\frac{5mol}{2L}$=2.5mol/L,故D正确;
故选B.
点评 本题考查混合物的计算、离子反应的计算,题目难度中等,注意从图象分析反应发生的情况,关键是根据图象判断溶液溶质的成分,试题培养了学生的分析能力及化学计算能力.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(K+)>c(CN-) | B. | c(CN-)>c(HCN) | ||
| C. | c(HCN)+c(CN-)=0.2mol•L-1 | D. | c(K+)+c(H+)=c(CN-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的底部 | |
| B. | 定容时,因不慎使液面高于容量瓶的刻度线,可用滴管将多余液体吸出 | |
| C. | 焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧至无色,然后再进行实验 | |
| D. | 过滤时,为加快过滤速率,可用玻璃棒快速搅拌漏斗中的悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液中通入足量二氧化硫:SO2+2OH-═SO32-+H2O | |
| B. | 石灰水与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 钠与水反应:Na+2H2O═2OH-+Na++H2↑ | |
| D. | 向少量碳酸氢钠溶液中滴加足量澄清石灰水:HCO${\;}_{3}^{-}$+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
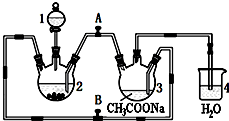 醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.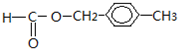 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com